
2013年7月23日,央视记者分别在北京崇文门附近的麦当劳、肯德基以及真功夫3家大型快餐店取回可食用冰块进行抽样检测。检测结果显示:3家快餐店食用冰块菌落总数严重超标。下列说法正确的是
A.肉毒杆菌有毒,可在其中加入硫酸铜使其变性后食用
B.肉毒杆菌在体内水解生成的氨基酸不能成为人体重要的营养物质
C.大肠杆菌分子中不一定含羧基和氨基
D.出血性大肠杆菌和油脂均为能水解的高分子化合物
科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:计算题
(本题共14分)
溴化钠是工业提溴的中间产物,也是重要的化工生产原料,回答下列问题。
56.工业上用氯气氧化卤水中的溴离子,吹出溴蒸气后用10% 的纯碱溶液吸收,反应的化学方程式为:
3Na2CO3+ 3Br2 → 5NaBr + NaBrO3 + 3CO2若生成标准状况下3.36 L CO2,吸收的Br2为________g。
57.吹出的溴蒸气中会含有少量未反应的氯气,用纯碱吸收后实际生成的是NaCl、NaBr和NaBrO3。若所得溶液中含0.1 mol NaCl与0.6 mol NaBr,则溶液中NaBrO3的物质的量为_______mol。
58.将纯碱吸收后所得的溶液浓缩,加入2 mol/L H2SO4后蒸馏可以回收纯溴:
5NaBr + NaBrO3 + 3H2SO4 → 3Na2SO4+ 3Br2↑+ 3H2O
已知向一定质量的浓缩液中加入300mL硫酸可回收81.6 g液溴,硫酸全部转化为硫酸钠。若改为加入180 mL硫酸,计算可回收的液溴的质量。
59.向0.3 mol NaBr固体中加入足量浓硫酸并微热,产生的气体呈红棕色,且残留物中不含溴元素。将所得气体通入280 mL 2 mol/L的Na2SO3溶液中,无任何气体逸出,最终得到只含NaBr、Na2SO4和NaHSO3三种溶质的无色溶液。求红棕色气体中各组分的化学式与物质的量。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项 | 现象或事实 | 解 释 |
A | 用热的纯碱溶液洗去油污 | Na2CO3可直接和油污反应 |
B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
C | Ca(OH)2溶液能溶解难溶的杂卤石(K2SO4?MgSO4?2CaSO4?2H2O)浸出K+ | 氢氧根离子与镁离子结合,使平衡向右移动 |
D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省五校高三第一次模拟联考理综化学试卷(解析版) 题型:填空题
【化学——选修5:有机化学基础】(15分)
有机物丙(C13H18O2)是一种香料,其合成路线如图所示。其中A的相对分子质量通过质谱法测得为56,它的核磁共振氢谱显示只有两组峰;D可以发生银镜反应,在催化剂存在条件下1 mol D与2 mol H2反应可以生成乙;丙中含有两个-CH3


(1)A的结构简式为 ;乙的分子式为 。
(2)C与新制Cu(OH)2悬浊液反应的化学方程式_________________。
(3)D所含官能团的名称是 ;D有多种同分异构体,其中与其所含官能团相同的同分异构体有 种(不考虑立体异构)。
(4)甲与乙反应的化学方程式为 。
(5)写出满足下列条件的有机物的结构简式 ⅰ与乙互为同分异构体;ⅱ遇FeCl3溶液显紫色;ⅲ其苯环上的一溴代物只有两种。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省五校高三第一次模拟联考理综化学试卷(解析版) 题型:选择题
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如下图所示,则下列有关说法中不正确的是

A.X为直流电源的负极,Y为直流电源的正极
B.阳极区pH增大
C.图中的b>a
D.该过程中的产品主要为H2SO4和H2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:填空题
(8分)近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
I CaSO4(s)+ CO(g) CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ·mol-l
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ·mol-l
II CaO(s) +3CO(g)+SO2(g) CaS(s)+3CO2(g) △H2=-394.0 kJ·mol-l
CaS(s)+3CO2(g) △H2=-394.0 kJ·mol-l
(1)若用K1、K2分别表示反应I、II的化学平衡常数,则反应1/2CaSO4(s)+2CO(g) 1/2CaS(s)+2CO2(g)的平衡常数K=_________(用含K1、K2的式子表示)
1/2CaS(s)+2CO2(g)的平衡常数K=_________(用含K1、K2的式子表示)
(2)某温度下在一密闭容器中若只发生反应I,测得数据如下:
t/s | 0 | 10 | 20 | 30 | 50 |
c(CO)mol/L | 3 | 1.8 | 1.2 | 0.9 | 0.9 |
前20 s 内v(SO2)=__________mo1·L-l·s-l,平衡时CO的转化率为__________。
(3)某科研小组研究在其它条件不变的情况下,改变起始一氧化碳物质的量,对反应IICaO(s) +3CO(g) +SO2 (g) CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):
CaS(s)+3CO2(g)的影响,实验结果如图所示(图中T表示温度):

①比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是_______________。
②图像中T2_____T1(填“高于”、“低于”、“等于”或 “无法确定”)判断的理由是____________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:选择题
用铂作电极电解1000 mL 0.1 mol/L AgNO3溶液,通电一段时间后关闭电源,测得溶液的质量减少了13.4 g。下列有关叙述正确的是(NA代表阿伏加德罗常数的值)
A.电解过程中流经外电路的电子数目为0.1NA
B.在标准状况下,两极共产生3.92L气体
C.电解后溶液的pH为2(假设溶液体积不变)
D.加入13.8 g Ag2CO3可将溶液彻底复原
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东师大附中高三第四次模拟考试理综化学试卷(解析版) 题型:选择题
下列说法中,正确的是
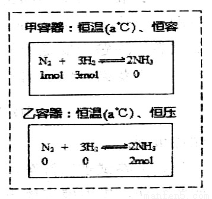
A.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
B.通过上图所示的不同途径,可建立相同的平衡,但反应过程中放出或吸收的热量可能不相等
C.C(石墨,s)=C(金刚石,s) △H> 0所以金刚石比石墨稳定
D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三1月检测化学试卷(解析版) 题型:选择题
甲溶液的pH是4,乙溶液的PH是5,甲溶液与乙溶液的c(H+)之比为
A.10:1 B.1:10
C.2:1 D.1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com