
����Ŀ��A��B��C��D��Ϊ��ѧ��ѧ�����Ĵ����A�ǵ��ʣ�����֮������ͼ�ķ�Ӧ��ϵ��
��1����A�ǵ���ɫ���壬C��D���������C������������Ҫ���ʣ�����C���ʿɵõ��м�ֵ�Ļ�ѧƷ��д������1�����1���ε����� ��
��2����B����̬�⻯�C��D���������һ���ɹ⻯ѧ������Ⱦ��B��C��һ�������·�Ӧ���ɵ�A�Ǵ�����Ҫ�ɷ֣�д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��3����D���ʾ������ԣ��ڢ۷�Ӧ��Ҫ��ǿ����Һ���ܷ�Ӧ��ͨ�������һ����������ЧӦ����Ҫ���壮�жϵ���A��Ԫ�������ڱ��е�λ���� ��д�ܷ�Ӧ���ӷ���ʽ ��
��4����A��̫���ܵ���õĹ�����ϣ�C��DΪ���Σ������������ơ������Ԫ��Ϊͬһ���壬����Һ���Լ��ԣ�д���ڷ�Ӧ�Ļ�ѧ����ʽ�� ��D�Ļ�ѧʽ�ǡ� ��
��5����A��Ӧ����㷺�Ľ������ܷ�Ӧ�õ�A���ڢݷ�Ӧ���õ�ͬһ�ַǽ������ʣ�C����Һ����ʴ��ӡˢͭ��·�壬д�÷�Ӧ�����ӷ���ʽ�� ��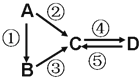
���𰸡����ᡢ����泥�������Ƶȣ���4NH3+6NO![]() N2+6H2O���������ڢ�A�壻AlO2��+2H2O+CO2�TAl��OH��3��+HCO3����Si+2NaOH+H2O=Na2SiO3+2H2����Na2CO3��Cu+2Fe3+=Cu2++2Fe2+
N2+6H2O���������ڢ�A�壻AlO2��+2H2O+CO2�TAl��OH��3��+HCO3����Si+2NaOH+H2O=Na2SiO3+2H2����Na2CO3��Cu+2Fe3+=Cu2++2Fe2+
����������1����A�ǵ���ɫ���壬C��D���������C������������Ҫ�����ж�ΪSO2 �� ����AΪS��CΪSO2 �� BΪH2S��DΪSO3 �� ����C���ʿɵõ��м�ֵ�Ļ�ѧƷ���������ö������������ȡ���ᣬ�ü����յõ�����淋ȣ��ʴ�Ϊ�����ᡢ����泥�������Ƶȣ���
��2����B����̬�⻯�C��D���������һ���ɹ⻯ѧ������Ⱦ���ж�ΪNO��NO2 �� B��C��һ�������·�Ӧ���ɵ�A�Ǵ�����Ҫ�ɷ֣��ƶ�AΪN2 �� BΪNH3 �� �÷�Ӧ�Ļ�ѧ����ʽ4NH3+6NO![]() 5N2+6H2O���ʴ�Ϊ��4NH3+6NO
5N2+6H2O���ʴ�Ϊ��4NH3+6NO![]() N2+6H2O��
N2+6H2O��
��3����D���ʾ��������ƶ�DΪAl��OH��3 �� �ܷ�Ӧ��ͨ�������һ����������ЧӦ����Ҫ���壬˵��CΪƫ������NaAlO2 �� �ڢ۷�Ӧ��Ҫ��ǿ����Һ���ж�AΪAl��BΪAlCl3 �� ����AΪAl��Ԫ�������ڱ��е�λ���ǵ������ڢ�A�壬�ܷ�Ӧ���ӷ���ʽ��AlO2��+2H2O+CO2�TAl��OH��3��+HCO3�� �� �ʴ�Ϊ��AlO2��+2H2O+CO2�TAl��OH��3��+HCO3����
��4����A��̫���ܵ���õĹ�����ϣ��ж�AΪSi��C��DΪ���Σ������������ơ������Ԫ��Ϊͬһ���壬����Һ���Լ��ԣ�˵����ˮ��ʼ��ԣ�CΪNa2SiO3 �� DΪNa2CO3 �� BΪSiO2����Ӧ�ڵĻ�ѧ����ʽΪ��Si+2NaOH+H2O=Na2SiO3+2H2����D�Ļ�ѧʽΪNa2CO3 �� �ʴ�Ϊ��Si+2NaOH+H2O=Na2SiO3+2H2����Na2CO3��
��5����A��Ӧ����㷺�Ľ������ƶ�ΪFe���ܷ�Ӧ�õ�A���ڢݷ�Ӧ���õ�ͬһ�ַǽ������ʣ��ƶ�ΪCl2 �� C����Һ����ʴ��ӡˢͭ��·�壬�ж�CΪFeCl3 �� DΪFeCl2 �� C����Һ����ʴ��ӡˢͭ��·�壬д�÷�Ӧ�����ӷ���ʽΪ��Cu+2Fe3+=Cu2++2Fe2+ �� �ʴ�Ϊ��Cu+2Fe3+=Cu2++2Fe2+ ��
��1����A�ǵ���ɫ���壬C��D���������C������������Ҫ�����ж�ΪSO2 �� ����AΪS��CΪSO2 �� BΪH2S��DΪSO3 �� ����C���ʿɵõ��м�ֵ�Ļ�ѧƷ���������ö�������Ĵ��������жϣ�
��2����B����̬�⻯�C��D���������һ���ɹ⻯ѧ������Ⱦ���ж�ΪNO��NO2 �� B��C��һ�������·�Ӧ���ɵ�A�Ǵ�����Ҫ�ɷ֣��ƶ�AΪN2 �� BΪNH3 �� �����ƶϳ���������д��ѧ����ʽ��
��3����D���ʾ��������ƶ�DΪAl��OH��3 �� �ܷ�Ӧ��ͨ�������һ����������ЧӦ����Ҫ���壬˵��CΪƫ������NaAlO2 �� �ڢ۷�Ӧ��Ҫ��ǿ����Һ���ж�AΪAl��BΪAlCl3 �� �����ƶϳ��������жϣ�
��4����A��̫���ܵ���õĹ�����ϣ��ж�AΪSi��C��DΪ���Σ������������ơ������Ԫ��Ϊͬһ���壬����Һ���Լ��ԣ�˵����ˮ��ʼ��ԣ�CΪNa2SiO3 �� DΪNa2CO3 �� BΪSiO2��
��5����A��Ӧ����㷺�Ľ������ƶ�ΪFe���ܷ�Ӧ�õ�A���ڢݷ�Ӧ���õ�ͬһ�ַǽ������ʣ��ƶ�ΪCl2 �� C����Һ����ʴ��ӡˢͭ��·�壬�ж�CΪFeCl3 �� DΪFeCl2 ��


 ����ʦ���һ��һ��ϵ�д�
����ʦ���һ��һ��ϵ�д� �Ͻ�ƽ��У����ϵ�д�
�Ͻ�ƽ��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fe2+��Fe3+��O22����CN����F�����л����ӵ��γɵĻ�������й㷺��Ӧ�ã� 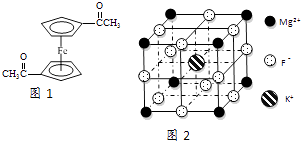
��1��C��N��Oԭ�ӵĵ�һ�������ɴ�С��˳����
��2��Fe2+��̬��������Ų�ʽΪ ��
��3����������ï���dz������Ϳ��������ṹ��ͼ1��ʾ����������̼ԭ�ӵ��ӻ���ʽ�� ��
��4�������K3Fe��CN��6�����ڵ��Ӵ������������������廥Ϊ�ȵ������һ�ַ��ӵĻ�ѧʽΪ �� ��֪��CN��2��ֱ���ͷ��ӣ������жԳ��ԣ���CN��2�Цм��ͦҼ��ĸ�����Ϊ ��
��5��F����������Fe3+�γ�[FeF6]3�� �� ��������Mg2+��K+�γ�һ��������ϵ�����Ӿ��壬�˾���Ӧ���ڼ������ṹ��ͼ2��ʾ���þ���Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ��ȼ�ϵ�����������ȼ�ϵ�ؾ������С���ŵ㡣һ����Һ̬�£�N2H4��Ϊȼ�ϵĵ��װ����ͼ��ʾ���õ���ÿ����е�������Ϊ��������KOH��Һ��Ϊ�������Һ�����й��ڸõ�ص�������ȷ����
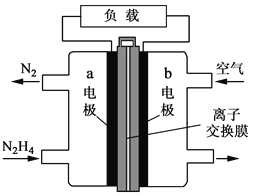
A. b������������Ӧ
B. a���ķ�Ӧʽ��N2H4��4OH����4e����N2����4H2O
C. �ŵ�ʱ��������a��������������b��
D. ���е����ӽ���Ĥ��ѡ�������ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѡ���뽺��֪ʶ�ص��ǣ� ��
A. �����з�ɢ�����ӵ�ֱ��������Һ�з�ɢ�ʵ�����ֱ��
B. �͵��Ȼ�����Һ�м�������������Һ�õ����ɫ����
C. �ƺ��뺣�ڴ��γ�������
D. ���������ܽ���ϡ�����������Ⱦ����ж��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯һ�����ڻ�ѧ�仯���ǣ� �� �ٵ���ڱ�ը�ۻ���������SO2ʹƷ����Һ��ɫ����ˮ����ͭ�ɰױ�����ҵ��O2�߰���ת��Ϊ���� �����Ũ�����Ƣ�16O��18O����ת����
A.�ڢۢܢߢ��
B.�ۢܢݢߢ�
C.�ڢۢޢߢ�
D.�ܢݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݷ�Ӧ��2H2S+O2=2S��+2H2O��4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O��Na2S+I2=2NaI+S�����������ʵ�������ǿ���ж���ȷ����
A. O2��I2��S B. H2S��NaI��H2O
C. S��I2��O2 D. H2O��NaI��H2S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯��������Ҫ��;����ۺ�������[Fe2(OH)n(SO4)3��n/2]m��һ������Ч��ˮ���������������������(�������Ļ��ϼ�Ϊ��6)��һ����Ҫ��ɱ����������ij����С��������·����Ʊ��������ֲ�Ʒ��

��ش��������⣺
��1����AΪH2O(g)�����Եõ�Fe3O4��д��H2O�ĵ���ʽ��________________��
��2����BΪNaClO3��ϡ���ᣬд��������Fe2������Fe3�������ӷ���ʽ___________________��
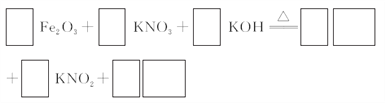
��3����CΪKNO3��KOH�Ļ���д������Fe2O3���ȹ����Ƶø�����صĻ�ѧ����ʽ������ƽ��___________
��4��Ϊ�ⶨ��Һ������Ԫ�ص��ܺ�����ʵ��������£�ȷ��ȡ20.00 mL��Һ���ڴ�����ƿ�У���������H2O2������pH��3�����ȳ�ȥ����H2O2���������KI��ַ�Ӧ������0.1 00 0 mol��L��1 Na2S2O3����Һ�ζ����յ㣬���ı���Һ20.00 mL��
��֪��2Fe3����2I��===2Fe2����I2 ��I2��2S2O![]() ===2I����S4O
===2I����S4O![]() ��
��
��д���ζ�ѡ�õ�ָʾ��________���ζ��յ�۲쵽������_______________________��
����Һ������Ԫ�ص��ܺ���Ϊ__________g��L��1�����ζ�ǰ��Һ��H2O2û�г��������ⶨ����Ԫ�صĺ�������________(����ƫ������ƫ��������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ��ȤС��Ϊ̽������Ũ���ᷴӦ�������ͼ1��ͼ2��ʾװ�ý���ʵ�顣 
��1���Ƚ���ʵ��װ�ã�ͼ2��ʾװ�õ��ŵ��ǣ� ���ܸ��õ������ж�����SO2 �� ��ֹ����Ⱦ������
����
��2����˵����SO2���������ʵ��������?
��3����Ӧһ��ʱ����õι���ȡA�Թ��е���Һ��������ˮ��Ϊ�����������������������ӵijɷ����������ֿ��ܣ� ��ֻ����Fe3������ֻ����Fe2��������Fe3������Fe2����
Ϊ��֤��Ŀ����ԣ�ѡ�������Լ�����д���пհף�
A��ϡ������Һ B��ϡ������Һ
C��KSCN��Һ D��KMnO4��Һ
E��NaOH��Һ F������KI��Һ
G��H2O2��Һ
��֤��ȡ�������ȵμ�������(���Լ���ţ���ͬ)�����ٵμ������� �� ������Һ��ɫ�ı仯��ȷ��������Ƿ���ȷ��
��֤����1.ȡ�������μ�������(���Լ����)����Һ����ɫ��ɫ�������к���Fe3�� �� ������Ӧ�����ӷ���ʽΪ��
����2.��ȡ�����������μӵ�������(���Լ����)����Һ����ɫ��Ϊɫ���������к���Fe2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����Һ�пɷ������·�Ӧ��
��2Fe2++Br2=2Fe3++2Br- ��2Br-+Cl2=Br2+2Cl- ��2Fe3++2I-=2Fe2++I2���ɴ��ж�����˵����ȷ����
A. ��Ԫ���ڷ�Ӧ���б���ԭ�������б�����
B. ��Ӧ���е���1molCl2����ԭʱ����1mol����ת��
C. ������ǿ��˳��Ϊ��Cl2>I2>Br2>Fe3+
D. ��ԭ��ǿ��˳��Ϊ��I->Fe2+>Br->Cl-
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com