
【题目】化工生产中常用FeS作为沉淀剂除去工业废水中的Pb2+,反应原理为FeS(s)+Pb2+(aq) ![]() PbS(s)+Fe2+(aq),下列有关叙述错误的是( )
PbS(s)+Fe2+(aq),下列有关叙述错误的是( )
A.达到平衡时,c(Pb2+)=c(Fe2+)
B.Ksp(FeS)大于Ksp(PbS)
C.该反应的平衡常数K=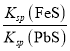
D.溶液中加入少量Na2S固体后,c(Fe2+)减小
科目:高中化学 来源: 题型:
【题目】已知某可逆反应m A(g)+n B(g) ![]() p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )
p C(g)在密闭容器中进行,下图表示在不同反应时间t时,温度T和压强p与反应物B在混合气体中的体积分数B%的关系曲线,由曲线分析,下列判断正确的是( )

A.T1<T2 p1>p2 m+n>p 放热反应B.T1>T2 p1<p2 m+n>p 吸热反应
C.T1<T2 p1>p2 m+n<p 放热反应D.T1>T2 p1<p2 m+n<p 吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组探究![]() 与
与![]() 溶液的反应,所用装置如下图所示
溶液的反应,所用装置如下图所示![]() 夹持仪器已略去
夹持仪器已略去![]() 。
。
![]() 实验室配制和保存
实验室配制和保存![]() 溶液应滴加少许______于试剂瓶中。
溶液应滴加少许______于试剂瓶中。
![]() 实验过程中需要配制
实验过程中需要配制![]()
![]() 溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、______。
溶液,所需要的玻璃仪器有:烧杯、量筒、玻璃棒、胶头滴管、______。
![]() 该小组同学向5mL
该小组同学向5mL![]()
![]() 溶液中通入足量的
溶液中通入足量的![]() ,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是______。
,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是______。
![]() 该小组同学在
该小组同学在![]() 中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
(查阅资料)![]() 离子在溶液中呈红棕色且具有较强的还原性,能被
离子在溶液中呈红棕色且具有较强的还原性,能被![]() 氧化为
氧化为![]() 与
与![]() 溶液反应生成红棕色
溶液反应生成红棕色![]() 离子的离子方程式是______;
离子的离子方程式是______;![]() 与
与![]() 在溶液中反应的离子方程式是______。
在溶液中反应的离子方程式是______。
![]() 为了安全起见,还可以在A、B装置之间加一个______装置。
为了安全起见,还可以在A、B装置之间加一个______装置。

![]() 若实验中用5mL一定浓度的浓
若实验中用5mL一定浓度的浓![]() 与适量Cu片充分反应,实验结束后,测得产生
与适量Cu片充分反应,实验结束后,测得产生![]() 的体积在标准状况下为672mL,向已冷却的A试管溶液中加入
的体积在标准状况下为672mL,向已冷却的A试管溶液中加入![]() 的NaOH溶液30mL时,恰好使
的NaOH溶液30mL时,恰好使![]() 完全沉淀。则所用浓
完全沉淀。则所用浓![]() 浓度为______。
浓度为______。![]() 忽略过程中溶液的体积变化
忽略过程中溶液的体积变化![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化锰为原料制取高锰酸钾晶体的实验流程如下:

下列说法正确的是
A. “灼烧”可在石英坩埚中进行
B. 母液中的溶质是K2CO3、KHCO3、KCl
C. “结晶”环节采用加热蒸发结晶的方法
D. “转化”反应中,生成的KMnO4和MnO2的物质的量之比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。回答下列问题(相关数据如下):
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
Sr(OH)2 | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
ⅡA元素氢氧化物 | Be(OH)2 | Mg(OH)2 | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 | ||||
25℃时饱和溶液浓度molL-1 | 8.00×10-6 | 5.00×10-4 | 2.00×10-2 | 6.00×10-2 | 2.00×10-1 | ||||
I.(1)SrO2中氧元素的化合价为___。Sr(OH)2的碱性比Mg(
(2)工业上可以用SrO与铝粉充分混合,在真空加热反应生成金属锶和3SrO8Al2O3,写出该反应的化学方程式___。
Ⅱ.以天青石(主要含有SrSO4和少量CaCO3杂质)生产Sr(OH)2xH2O的工艺如下:
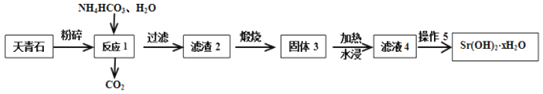
(3)滤渣2为混有CaCO3的SrCO3,写出生成SrCO3的化学方程式___。
(4)加热水浸固体3是为了获得较为纯净的Sr(OH)2涪液,此时应缓慢加热使沉淀颗粒长大,有利于___。
(5)从趁热过滤后的滤液中得到Sr(OH)2xH2O产品的步骤为降温结晶、过滤、洗涤、干燥。为得到较大颗粒的Sr(OH)2xH2O晶体,可采用的方法是___(填一种)。
(6)取m g纯净Sr(OH)2xH2O产品溶于水,加入过量纯碱溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=___(用含m、n的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42—)在溶液中呈紫红色。

(1)电解过程中,X 极区溶液的 pH__(填“增大”“减小”或“不变”)。
(2)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣=FeO42—+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少__g。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
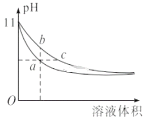
A. a点导电能力比b点强
B. a、c两点的c(H+)相等
C. 与盐酸完全反应时,消耗盐酸体积Va>Vc
D. b点的Kw值大于c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒电池是一种新型酸性硫酸盐二次电池,钒电池失效后,废电解液回收利用的一种工艺如下:

已知:a.+5价钒在溶液中存在如下平衡: ![]() 。
。
b.部分含钒物质在水中的溶解性见下表:

(1)氧化工序中,其他价态的钒全部氧化成![]() ,完成
,完成![]() 氧化的离子方程式:
氧化的离子方程式:
_________V2++_________ClO3-+ _________=_________VO2+__________C1-+ __________NaClO和NaClO3均可作氧化剂,该工序中不选择NaClO作氧化剂的理由是_________。
(2)浓缩工序中,加入NaOH的作用是_________。
(3)沉钒工序的化学方程式为_________。
(4)煅烧偏钒酸铵时,固体(取234g NH4VO3)质量的减少量随温度变化的曲线如图所示,100~200℃时产生的一种气体的电子式为________,300~350℃时发生反应的化学方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com