
甲醇合成反应及其能量变化如图所示:
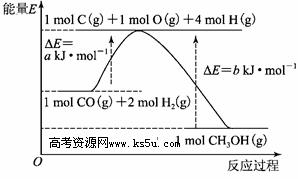
(1)写出合成甲醇的热化学方程式____________________。
(2)实验室在1 L的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min |
| 300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(2)在300 ℃反应开始10 min内,H2的平均反应速率为v(H2)=_____。
(3)在500 ℃达到平衡时,平衡常数K=________。
(4)在另一体积不变的密闭容器中,充入1.2 mol CO和2.0 mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半。计算该条件下H2的转化率为________。
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇。使用铜基催化剂后,该反应中a的大小变化对反应热ΔH有无影响,_________________。
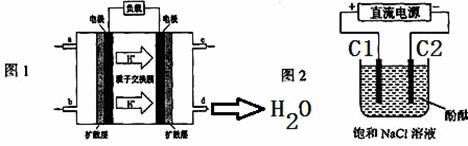
(6)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图1所示。请写出从C口通入O2发生的电极反应式_____________。
(7)用上述电池做电源,用图2装置电解饱和食盐水(C1、C2均为石墨电极)。
①该反应的离子方程式________________________。
②电解开始后在电极___________的周围(填“C1”或“C2”)先出现红色。
科目:高中化学 来源: 题型:

| 时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源:2013届山西省康杰中学等四校高三第一次联考化学试卷(带解析) 题型:填空题
(共10分)甲醇合成反应及其能量变化如图所示:
(1)写出合成甲醇的热化学方程式________________________________。
实验室在1 L的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min |
| 300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省等四校高三第一次联考化学试卷(解析版) 题型:填空题
(共10分)甲醇合成反应及其能量变化如图所示:

(1)写出合成甲醇的热化学方程式________________________________。
实验室在1 L的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
|
时间浓度(mol/L)温度 |
10 min |
20 min |
30 min |
40 min |
50 min |
60 min |
|
300 ℃ |
0.40 |
0.60 |
0.75 |
0.84 |
0.90 |
0.90 |
|
500 ℃ |
0.60 |
0.75 |
0.78 |
0.80 |
0.80 |
0.80 |
(2)在300 ℃反应开始10 min内,H2的平均反应速率为v(H2)=________。
(3)在500 ℃达到平衡时,平衡常数K=________。
(4)在另一体积不变的密闭容器中,充入1.2 mol CO和2.0 mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半。计算该条件下H2的转化率为________。
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇。该反应中a的大小对反应热ΔH有无影响,___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇合成反应及其能量变化如图所示:

(1)写出合成甲醇的热化学方程式____________________。
(2)实验室在1 L的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min |
| 300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(2)在300 ℃反应开始10 min内,H2的平均反应速率为v(H2)=_____。
(3)在500 ℃达到平衡时,平衡常数K=________。
(4)在另一体积不变的密闭容器中,充入1.2 mol CO和2.0 mol H2,一定条件下达到平衡,测得容器中压强为起始压强的一半。计算该条件下H2的转化率为________。
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇。使用铜基催化剂后,该反应中a的大小变化对反应热ΔH有无影响,_________________。
(6)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图1所示。请写出从C口通入O2发生的电极反应式_____________。
(7)用上述电池做电源,用图2装置电解饱和食盐水(C1、C2均为石墨电极)。
①该反应的离子方程式________________________。
②电解开始后在电极___________的周围(填“C1”或“C2”)先出现红色。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇合成反应及其能量变化如图所示:

(1)写出合成甲醇的热化学方程式 。
(2)实验室在1 L的密闭容器中进行模拟合成实验。将1 mol CO和2 mol H2通入容器中,分别恒温在300 ℃和500 ℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
| 时间浓度(mol/L)温度 | 10 min | 20 min | 30 min | 40 min | 50 min | 60 min |
| 300 ℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500 ℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(2)![]() 在300 ℃反应开始10 min内,H2的平均反应速率为v(H2)=__________。
在300 ℃反应开始10 min内,H2的平均反应速率为v(H2)=__________。
(3)该反应的平衡常数表达式为K=_____________。
(4)在另一体积不变的密闭容器中,充入1.2 mol CO和2.0 mol H2,一定条件下达到平衡,测![]() 得容器中压强为起始压强的一半。计算该条件下H2的转化率为________。
得容器中压强为起始压强的一半。计算该条件下H2的转化率为________。
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇。使用铜基催化剂后,该反应中a的大小变化对反应热ΔH有无影响____________(填有影响或无影响)。
(6)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图1所示。
请写出发生的电极反应式正极: 、
负极:
(7)用上述电池做电源,用图2装置电解饱和食盐水(C1、C2均为石墨电极)。
①该反应的离子方程式________________________。
②电解开始后在电极___________的周围(填“C1”或“C2”)先出现红色。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com