
(1)25。C时,0.1mol/L的HA溶液中c(H+)/c(OH-)=1010.请回答下列问题:
①HA是__________(填“强电解质”或“弱电解质”)。
②在加水稀释HA溶液的过程中,随着水量的增加而增大的是_________(填字母)。
A. c(H+)/c(HA) B. c(HA) /( A-)
C. c(H+)与c(OH-)的乘积 D.c(OH-)
(2)已知:CH4+H2O=CO(g)+3H2(g)  H=+206.2kJ·mol-1
H=+206.2kJ·mol-1
CH4+CO 2=2CO(g)+2H2(g)  H=-247.4kJ·mol-1
H=-247.4kJ·mol-1
CH4(g)与H2O(g)反应生成CO 2(g)和H2(g)的热化学方程式为__________.
(3)下图是利用甲烷燃料电池电解50 mL 2mol/L的氯化铜溶液的装置示意图:
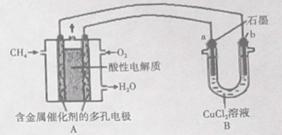
请回答:
①甲烷燃料电池的负极反应式为_______________.
②当线路中有0.6mol电子通过时,B中阳极产物的质量为___________g.
【知识点】弱电解质的电离 盖斯定律 电化学 F3 F4 H1
【答案解析】(1)①弱电解质(2分) ②AD(3分)(只选一个且正确给1分,出现错误选项不得分)
(2))CH4(g)+2H2O(g) =CO2(g) +4H2(g) △H=+659.8 kJ·mol-1(3分)
(3)CH4-8e-+2H2O=CO2+8H+(3分) 10.3(3分)
解析:(1)①25℃时,0.1mol•L-1的某酸HA中,如果该酸是强酸,c(H+)/c(OH-)=1012而溶液中c(H+)/c(OH-)=1010所以该酸是弱酸,弱酸中存在电离平衡。 ②A.加水稀释促进酸电离,氢离子浓度、酸浓度、酸根离子浓度都降低,但氢离子浓度减小的量小于酸分子减小的量,所以c(H+)/c(HA)增大,故A正确;
B.加水稀释促进酸电离,酸浓度、酸根离子浓度都降低,但酸根离子浓度减小的量小于酸分子减小的量,所以c(HA) /( A-)减小,故B错误;
C.温度不变,水的离子积常数不变,故C错误;
D.加水稀释促进酸电离,氢离子浓度降低,但氢氧根离子浓度增大,故D正确;
(2)利用盖斯定律,用已知的第一个热化学方程式乘以2减去第二个热化学方程式得:CH4(g)+2H2O(g) =CO2(g) +4H2(g) △H=+659.8 kJ·mol-1
(3)①根据负极发生失电子的反应,以及电解质溶液显酸性得:CH4-8e-+2H2O=CO2+8H+
②甲烷燃料电池电解50 mL 2mol/L的氯化铜溶液,溶液中n(Cl-)=0.2mol,电解一段时间后,阳极电极反应:2Cl--2e-=Cl2↑,0.2mol氯离子失电子0.2mol生成氯气0.1mol,所以氢氧根离子失电子0.4mol,4OH--4e-=2H2O+O2↑,转移0.4mol电子生成氧气0.1mol,共生成气体的质量0.1×71+0.1×32=10.3(克)
【思路点拨】本题考查了电解质溶液、原电池电解池原理的分析应用,电极反应的书写和电子守恒的计算是解题关键,题目难度中等。


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
1,3一丁二烯的一类二烯烃能与具有双键的化合物进行1,4加成反应生成环状化合物,这类反应称为双烯合成,例如:
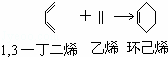
在下列横线上写出适当的反应物或生成物的结构简式,完成下列反应的化学方程式:
(1)→
(2) + →
(3)在(1)和(2)中分别产生副产物其反应类型与上述反应相同请写出(1)中的副产物的结构简式 (含有环己烯结构单元).
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容中发生下列反应aA(g)⇌cC(g)+dD(g),压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
|
| A. | A的转化率变大 | B. | 平衡向正反应方向移动 |
|
| C. | D的体积分数变大 | D. | a<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝—冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:2Al2O3 4Al+3O2↑
4Al+3O2↑
加人冰晶石的作用是_____________________。

(2)上述工艺所得铝材中往往含有少最Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为_____________,下列可作阴极材料的是____________(填字母序号)。
A.铝材 B.石墨 C.铅板 D.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为__________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是______________________________。
(5)下列说法正确的是(填字母序号)。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组对电化学问题进行了实验研究。
(1)利用下图装置探究金属的电化学腐蚀,接通电路发现灵敏电流计指针发生偏转,盐桥中K+向______槽(填“a”或“b”或“c”)移动。写出正极的电极反应_________________________。
(2)如何检验a槽中生成的阳离子________________________________________。
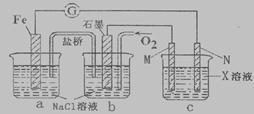
(3)在c槽中欲实现Cu+2H2O=Cu (OH)2+H2↑的反应,则电极_________(填"M"或“N")一定是铜电极。c槽中电解质X可以是下列_________________物质(填选项)
A. H2SO4 B. NaNO3 C. MgCl2 D. KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、W为原子序数依次增大的5种短周期元素。X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍。Z与其同主族的短周期元素可形成常见气体甲。X、Y、Z 3种元素形成化合物乙。下列说法不正确的是 ( )
A.原子半径:W>Y>Z>M>X B.化合物乙中一定只有共价键
C.由W元素形成的单质以及W与Z两元素形成的化合物都是原子晶体
D.X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM,沸点X2Z>XM
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质在水溶液中电离,其电离方程式错误的是()
A. Al2(SO4)3=2Al3++3(SO4)2﹣ B. NaHSO4=Na++H++SO42﹣
C. MgCl2=Mg2++Cl2﹣ D. Ba(OH)2=Ba2++2OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
关于Na2O和 Na2O2的叙述中错误的是()
A. Na2O是白色固体,Na2O2是淡黄色固体
B. 两物质都是碱性氧化物,其中氧元素的化合价都是﹣2价
C. 两者都能和水、二氧化碳、盐酸发生反应
D. Na2O2比Na2O稳定,Na2O在一定条件下可转化为Na2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com