
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 复分解反应 | B. | 化合反应 | C. | 置换反应 | D. | 分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫可用于抑制酒类中细菌生长,可在葡萄酒中微量添加 | |
| B. | 二氧化硫能使品红褪色,加热后不恢复到红色 | |
| C. | 二氧化硫使酸性高锰酸钾褪色,体现了二氧化硫的漂白性 | |
| D. | 二氧化硫属于碱性氧化物,可以用NaOH溶液吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的HA溶液与pH=12的KOH溶液等体积混合:c(H+)>c(OH-) | |
| B. | 0.1 mol/L的NaHC2O4溶液,其pH=4:c(HC2O4-)>c(H+)>c(H2C2O4)>c(C2O42-) | |
| C. | 醋酸钠和醋酸的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1 mol/L的NaHSO3溶液中:c(H+)+c(H2SO3)=c(SO32-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
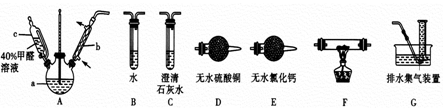

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com