
| A. | 14g N2和32g O2 | B. | 34g NH3 和4g H2 | ||
| C. | 2LCO2和2LH2O | D. | 11.2LO2和0.5molO2 |
分析 结合N=nNA、n=$\frac{m}{M}$、n=$\frac{V}{Vm}$计算.
解答 解:A.14g N2的物质的量为$\frac{14g}{28g/mol}$=0.5mol,32g O2的物质的量为$\frac{32g}{32g/mol}$=1mol,由N=nNA可知,分子数不同,故A错误;
B.34g NH3的物质的量为$\frac{34g}{17g/mol}$=2mol,4g H2的物质的量为$\frac{4g}{2g/mol}$=2mol,由N=nNA可知,分子数相同,故B正确;
C.2LCO2和2LH2O的温度、压强未知,无法确定物质的量,故C错误;
D.温度、压强未知,11.2LO2的物质的量不能确定,故D错误;
故选B.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、体积的关系为解答的关键,侧重分析与计算能力的考查,选项C为解答的易错点,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:填空题
序号 | 时间/min 物质的量/mol 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
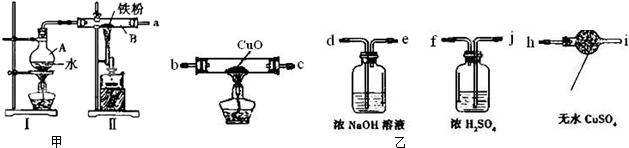
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ||||
| E | B | C | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
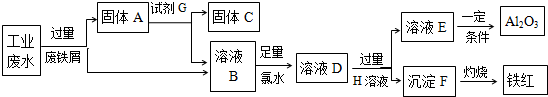
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com