
| A. | 等质量的硫蒸汽和硫固体分别在氧气中完全燃烧,后者放出的热量少 | |
| B. | 1molH2在足量氯气中完全燃烧所放出的热量,是H2的燃烧热 | |
| C. | HCl与NaOH反应的中和热△=-57.3kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-2×(-57.3)kJ•mol-1 | |
| D. | 一定条件下,0.2molSO2(g)与0.1molO2(g)混合充分反应时放出的热量为18kJ,则有SO2(g)+O2(g)═2SO3(g)△H=-180kJ•mol-1 |
分析 A、硫蒸汽所含能量比硫固体高;
B、燃烧热是指1mol可燃物在氧气中完全燃烧生成稳定的氧化物时所放出的热量;
C、中和热即在稀溶液中,强酸和强碱当生成1mol水时所放出的热量;
D、二氧化硫和氧气的反应是可逆反应.
解答 解:A、硫蒸汽所含能量比硫固体高,所以等物质的量的硫蒸汽和硫固体分别完全燃烧,前者放出热量多,后者放出的热量少,故A正确;
B、燃烧热是指1mol可燃物在氧气中完全燃烧生成稳定的氧化物时所放出的热量,故1mol氢气在氯气中燃烧所放出的热量不叫氢气的燃烧热,故B错误;
C、中和热即在稀溶液中,强酸和强碱当生成1mol水时所放出的热量,中和热的数值是确定的,即HCl与NaOH反应的中和热△=-57.3kJ•mol-1,H2SO4和Ca(OH)2反应的中和热△H也为-57.3kJ•mol-1,故C错误;
D、二氧化硫和氧气的反应是可逆反应,不能进行完全,故0.2molSO2(g)与0.1molO2(g)混合充分反应时放出的热量为18kJ,则意味这当反应掉0.2molSO2(g)与0.1molO2(g)时,反应放出的热量大于18KJ,故SO2(g)+O2(g)═2SO3(g)△H<-180kJ•mol-1,故D错误.
故选A.
点评 本题考查了燃烧热、中和热的概念 和反应热的大小比较,应注意的是燃烧热是指1mol可燃物在氧气中完全燃烧生成稳定的氧化物时所放出的热量.


 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L 氮气所含的原子数目为NA | |
| B. | 在反应3SiO2+6C+2N2=Si3N4+6CO,生成1 mol Si3N4时共转移12 NA电子 | |
| C. | 1molNa2O2固体中含离子总数为4 NA | |
| D. | 25℃时pH=13的NaOH溶液中含有Na+的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | 向氯化铁溶液中加入NaOH溶液,可制得Fe(OH)3胶体 | |
| C. | 固体的NaCl不导电,熔融态的NaCl可以导电 | |
| D. | 在河流入海口处易形成三角洲原理与胶体的性质无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘和干冰的升华 | |
| B. | 分别将NaHSO4熔化、溶解于水 | |
| C. | HCl和MgCl2的溶解 | |
| D. | 常压下分别将NaHCO3高温加热、溶解于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ),M的一种合成路线如图(部分反应试剂和条件省略).
),M的一种合成路线如图(部分反应试剂和条件省略).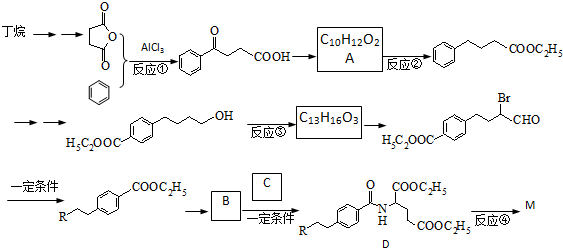
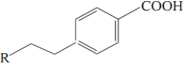 ,C
,C ;
;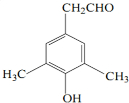 或
或
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Kw/c(H+)=1 mol•L-1的溶液中:Na+、SiO32-、I-、CO32- | |
| B. | 氨水中:Al3+、K+、F-、NO3- | |
| C. | pH=1的溶液中:NH4+、Na+、SO42-、CH3COO- | |
| D. | 0.1 mol•L-1的NaHSO4溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钾和氧化汞都属于氧化物 | B. | 氧气和臭氧都属于单质 | ||
| C. | 碳酸钙和甲烷都属于有机物 | D. | 火碱和纯碱都属于碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Ⅰ有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:
Ⅰ有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题: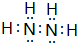 .将N2H4和O2通入到由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为N2H4-4e-+4OH-=N2↑+4H2O.
.将N2H4和O2通入到由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为N2H4-4e-+4OH-=N2↑+4H2O. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com