
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使紫色石蕊试剂显红色的溶液:NH4+、K+、[Al(OH)4]-、NO3-
B.稀HNO3溶液: Na+、Mg2+、SO42-、Cl-
C.FeCl3溶液:K+、Na+、I-、SO42-
D.由水电离产生的c(H+)=10-13 mol·L-1的溶液:K+、Na+、Cl-、HCO3-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在一条鱼、虾几乎绝迹的小河边从上游到下游依次有四座工厂:甲、乙、丙、丁,它们排出的废液里,每厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种。某中学环保小组对河水检测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍清。请回答:
(1)四座工厂排出的废液里含有的污染物是:甲__________;乙________;丙________;丁________。
(2)在丁的下游某处取出的河水中,肯定含有的离子是__________________________________。
(3)小河中鱼、虾几乎绝迹的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
北京2008奥运会金牌直径为70mm,厚6mm.某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)制成.为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误( )
A.硫酸铜溶液, B.盐酸, C.稀硝酸, D.硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为
aTiO2 + bCl2+eC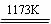 aTiCl4+eCO Ⅰ
aTiCl4+eCO Ⅰ
TiCl4+2Mg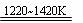 Ti+2MgCl2 Ⅱ
Ti+2MgCl2 Ⅱ
关于反应Ⅰ、Ⅱ的分析不正确的是
①TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂;②C、Mg在两个反应中均被还原;③在反应Ⅰ、Ⅱ中Mg的还原性大于C,C的还原性大于TiCl4;
④a=1,b=e =2 ⑤每生成19.2 g Ti,反应Ⅰ、Ⅱ中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
工业催化剂K3[Fe(C2O4)3]·3H2O是翠绿色晶体,在421~553℃时,分解为Fe2O3、K2CO3、CO、CO2、H2O。实验室由草酸亚铁晶体(FeC2O4·2H2O)、草酸钾(K2C2O4)、草酸(H2C2O4)和双氧水(H2O2)混合制备:
2FeC2O4·2H2O + H2O2+ 3K2C2O4+ H2C2O4=2K3[Fe(C2O4)3]·3H2O
(1)[Fe(C2O4)3]3-的名称是_______________。
(2)制备过程要防止草酸被H2O2氧化,写出草酸被H2O2氧化的化学方程式_________。
(3)配合物的稳定性可以用稳定常数K来衡量,如Cu2+ + 4NH3 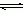 [Cu(NH3)4]2+,其稳定常数表达式为:
[Cu(NH3)4]2+,其稳定常数表达式为: 。已知K [Fe(C2O4)3]3-=1020,K [Fe(SCN)3]= 2×103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素? (填“是”、“否”)。 若选“否”,请设计检验K3[Fe(C2O4)3]·3H2O中铁元素的方案。__________________________。
。已知K [Fe(C2O4)3]3-=1020,K [Fe(SCN)3]= 2×103,能否用KSCN溶液检验K3[Fe(C2O4)3]·3H2O中的铁元素? (填“是”、“否”)。 若选“否”,请设计检验K3[Fe(C2O4)3]·3H2O中铁元素的方案。__________________________。
(4)铁元素可形成多种配合物,其中一种配合物钾盐A是有争议的食品添加剂。经组成分析A仅含K、Fe、C、N四种元素。取36.8g A加热至400℃,分解成KCN、Fe3C、C、N2,生成的氮气折合成标准状况下的体积为2.24L,Fe3C质量是C质量的3倍,Fe3C物质的量是氮气物质的量的1/3。则A的化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是( )
| X | ||
| Y | Z | W | |
A.原子半径:W>Z>Y>X
B.含Y元素的盐溶液一定显酸性
C.最简单气态氢化物的热稳定性:Z>W
D.X对应的最高价氧化物对应的水化物的酸性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化还原反应实际上包含氧化和还原两个过程。
(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:
SO2+2H2O – 2e– → SO42– + 4H+;
(2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,该反应中还原过程的反应式为:Cl2 + 2e– → 2Cl–。 在(1)和(2)反应中均会生成产物X,则X的化学式为( )
A.NaClO B.NaClO4 C.HClO D.ClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。
请回答下列问题:
(1)工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝。上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为 ,下列可作阴极材料的是__________。
A.铝材 B.石墨 C.铅板 D.纯铝
(2)阳极氧化能使金属表面生成致密的氧化膜,装置如下图所示。以稀硫酸为电解液,铝阳极发生的电极反应式为__________________________________。
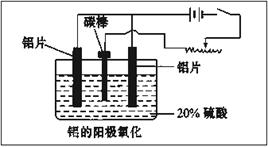
(3)下列说法正确的是 。
A.阳极氧化是应用原电池原理进行金属材料表面处理的技术
B.铝的阳极氧化可增强铝表面的绝缘性能
C.铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D.铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式____________。
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法正确的是____________(填序号)。
A.原子半径: Rb>I B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
⑶若XM3最初水解产物是XH3和HMO,则X、M元素的电负性大小顺序是:X_____M((填>、<、或=);若已知磷与M元素电负性关系是:P<M,则PM3水解的化学反应方程式是 。
(4)已知QM3的熔点为190℃(2.02×105Pa),但它在180℃即开始升华,则QM3是_________(填“离子化合物”或“共价化合物”),如何通过实验判别__________________。在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g/L,则QM3的结构式为_________。
(5)X、Y组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com