
丹参素能明显抑制血小板的聚集.其结构如右下图所示。下列有关说法正确的是
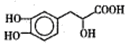
A. 丹参素在C原子上取代H的一氯代物有4种
B. 在Ni催化下lmol丹参素最多可与4molH2加成
C. 1mol丹参素在一定条件下与足量金属钠反应可生成4molH2
D. 丹参素能发生取代、消去、中和、氧化等反应
科目:高中化学 来源:2017届吉林省长春市高三下学期第二次质量监测理综化学试卷(解析版) 题型:简答题
2016年9月,“乔歌里1号”中国首台静默移动发电站MFC30正式问世,MFC30是基于甲醇重整制氢燃料电池发电技术。
(1)甲醇制氢方式主要有以下三种:反应Ⅰ甲醇水蒸气重整制氢:CH3OH(g)+H2O(g)  CO2(g)+3H2(g) △H1=+49.4 kJ/mol反应Ⅱ甲醇分解制氢:CH3OH(g)
CO2(g)+3H2(g) △H1=+49.4 kJ/mol反应Ⅱ甲醇分解制氢:CH3OH(g) CO(g)+2H2(g) △H2=+90.6 kJ/mol反应Ⅲ气态甲醇氧化重整制氢同时生成二氧化碳和氢气:
CO(g)+2H2(g) △H2=+90.6 kJ/mol反应Ⅲ气态甲醇氧化重整制氢同时生成二氧化碳和氢气:
①已知CO的燃烧热为283.0 kJ/mol,则反应Ⅲ的热化学反应方程式为____________。
②该三种制氢方式中,等量的甲醇产生氢气最多的是反应____________。(填“Ⅰ”、“Ⅱ”、“Ⅲ”)
(2)实验室模拟反应Ⅰ甲醇水蒸气重整制制氢观察,合成气组成n(CH3OH): n(H2O)=1∶1时,体系中甲醇的平衡转化率与温度和压强的关系如图所示。

①该反应的平衡常数表达式为____________________。
②当温度为250℃、压强为P2时,反应达平衡时H2的体积分数为____________。
③图中的压强由小到大的顺序是____________。
(3)MFC30燃料电池是以氢为燃料,Li2CO3与K2CO3混合的碳酸盐为电解质的高温型燃料电池,其负极的电极反应式为____________,正极上通入的气体为____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二3月学业水平测试化学试卷(解析版) 题型:选择题
下列有机化学方程式及反应类型均正确的是( )
A. CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O 脂化反应
CH3COOCH2CH3+H2O 脂化反应
B. CH2=CH2+HOCl → HOCH2—CH2Cl 加聚反应
C. 2CH3CH2OH+O2 2CH3CHO+H2O 氧化反应
2CH3CHO+H2O 氧化反应
D. CH3Cl+Cl2 CH2Cl2+HCl 取代反应
CH2Cl2+HCl 取代反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二3月学业水平测试化学试卷(解析版) 题型:选择题
科研人员发现放射性同位素钬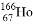 可有效地治疗肝癌。该同位素原子核内中子数与电子数之差为( )
可有效地治疗肝癌。该同位素原子核内中子数与电子数之差为( )
A. 32 B. 67 C. 99 D. 166
查看答案和解析>>
科目:高中化学 来源:2017届四川省乐山市高三第二次调查研究考试理科综合化学试卷(解析版) 题型:简答题
碳酸亚铁(FeCO3)是菱镁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3生成Fe2O3。
I.已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393 kJ/mol 2FeCO3(s)=2Fe(s)+ 3O2(g) △H=+148OkJ/mol
(1)请写出FeCO3在空气中煅烧生成Fe2O3的热化学方程式_______。
Ⅱ.生成的FeO和Fe2O3在一定条件下被还原为金属铁。
(2)据报道一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g) △H>0
① 原子序数为26的铁元素位于元素周期表的第_______周期。
②反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量消耗4.8g。则该段时间内用H2表达的平均反应速率为____________。
③将一定量的Fe2O3(s)和一定量的CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是___________。
a.CH4的转化率等于CO的产率 b.混合气体的平均相对分子质量不变
c.v正(CO):v逆(H2)=1:2 d.固体的总质量不变
(3)FeO可用CO进行还原,已知:t℃时,FeO(s)+CO(g) Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Fe(s)+CO2(g),K=0.5,若在1L密闭容器中加入0.04mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______。
Ⅲ. Fe2O3还可用来制备FeCl3,FeCl3在水溶液中的水解分三步:
Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++ H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)2++ H2O Fe (OH)3+H+ K3
Fe (OH)3+H+ K3
(4)以上水解反应的平衡常效K1、K2、K3由大到小的顺序是_______。通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O===Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是__________(填字母)
a.加水稀释 b.加入少量NaCl固体 c.升温 d.加入少量Na2CO3固体
查看答案和解析>>
科目:高中化学 来源:2017届河南省安阳市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
黑火药是我国古代的四大发明之一,距今已有1000多年的历史,其成分是木炭(C)、硫粉(S)和硝酸钾(KNO3)。回答下列有关问题:
(1)黑火药爆炸生成无毒的气体和K2S,该反应的化学方程式为________________。
(2)Se与S同主族,则Se原子的核外电子排布式为〔Ar〕________,有____对成对电子。
(3)C、N、O、K的电负性由大到小的顺序是_________________。
(4) 黑火药爆炸除生成K2S外,还生成少量K2S2,其结构类似于Na2O2。则K2S2中含有的化学键类型为_______________。
(5) K2S遇酸生成H2S,H2S分子中,S原子的杂化轨道类型是_________;KNO3可电离出NO3-,NO3-的空间构型是______________。
(6) K2S的晶胞结构如右图所示。其中K+的配位数为_______,若K2S晶体的密度为ρg·cm-3,则晶胞中距离最近的两个S2-核间距为_________cm(用NA表示阿伏伽德罗常数的值)
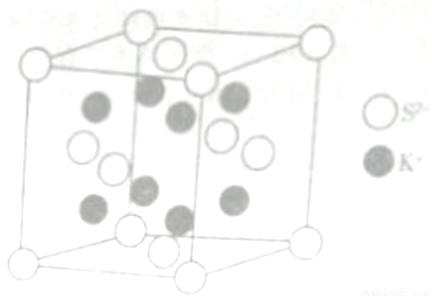
查看答案和解析>>
科目:高中化学 来源:2017届河南省安阳市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列实验对应的现象及结论均正确,且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向稀硝酸与过量铜粉反应后的溶液中滴加稀硫酸 | 有气泡生成 | 常温下,铜与稀硫酸反应生成SO2 |
B | 在酒精灯上加热铝箔 | 铝熔化,但熔化的铝不滴落 | Al2O3的熔点比Al高 |
C | 向Fe(SCN)3溶液中滴加稀NaOH溶液 | 溶液有红色变为红褐色 | 减小反应物浓度、平衡向逆反应方向移动 |
D | 选用酚酞作试剂,用NaOH溶液滴定醋酸溶液 | 溶液变为粉红色 | NaOH溶液过量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届湖北省黄冈市高三3月质量检测理科综合化学试卷(解析版) 题型:填空题
[化学-选修3:物质结构与性质]
铁氧体是一种磁性材料,具有广泛的应用。 -
(1)基态铁原子的核外电子排布式为[Ar]_______。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2 ]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是____________;醋酸钠中碳原子的杂化类型是_________。
(3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较下表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因________。
N2H4 | NH3 | |
熔点/℃ | 2 | -77.8 |
沸点/℃ | 113.5 | -33.5 |
(4)下图是从铁氧体离子晶体Fe3O4中,取出的能体现其晶体结构的一个立方体,则晶体中的氧离子是否构成了面心立方最密堆积______(填“是”或“否”),该立方体是不是Fe3O4的晶胞______(填“是”或“否”),立方体中三价铁离子处于氧离子围成的_____空隙(填空间结构)。

(5)解释该Fe3O4晶体能导电的原因________,根据上图计算Fe3O4晶体的密度_____g•cm-3。 (图中a=0.42nm,计算结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一下学期第一次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 含1molFeCl3的饱和溶液滴入沸水中得到胶体数目为NA
B. 在标准状况下,22.4LCl2和HCl的混合气体中含有的分子总数为2×6.02×1023
C. 常温常压下,7.8gNa2S固体和7.8gNa2O2固体中含有的阴离子数目均为0.1NA
D. 标准状况下,Na2O2与足量的CO2反应生成2.24LO2,转移电子数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com