
 W、X、Y、Z、M、Q均为稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的电子总数的4倍,Z与M最外层电子数相同,X与M在周期表中的位置如图:
W、X、Y、Z、M、Q均为稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的电子总数的4倍,Z与M最外层电子数相同,X与M在周期表中的位置如图: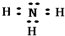 .
.分析 W、X、Y、Z、M、Q均为稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的电子总数的4倍,W只能为H,则X为第二周期ⅣA族元素,即X为C元素;由X与M在周期表中的位置可知,M为S,Z与M最外层电子数相同,Z为O,结合原子序数可知Y为N,以此来解答.
解答 解:W、X、Y、Z、M、Q均为稀有气体外的短周期元素,其原子序数依次增大,X的最外层电子数是W的电子总数的4倍,W只能为H,则X为第二周期ⅣA族元素,即X为C元素;由X与M在周期表中的位置可知,M为S,Z与M最外层电子数相同,Z为O,结合原子序数可知Y为N,
(1)W与Y形成简单化合物为NH3,其电子式为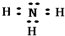 ,故答案为:
,故答案为: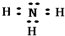 ;
;
(2)C、N可分别与O以原子个数比1:1形成化合物丙和丁分别为CO、NO,在催化剂存在条件下,丙与丁发生反应,生成单质N2和另一种化合物戊,戊为CO2,该反应的化学方程式为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
(3)由H、N、O、S组成的离子化合物有亚硫酸氢铵和硫酸氢铵,硫酸氢铵溶液呈强酸性,氢离子和亚硫酸氢根离子反应生成二氧化硫和水,反应方程式为SO32-+2H+=SO2↑+H2O 或 HSO3-+H+=SO2↑+H2O,
故答案为:SO32-+2H+=SO2↑+H2O 或 HSO3-+H+=SO2↑+H2O.
点评 本题考查位置、结构、性质,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意(3)为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1s22s22p5 | B. | 1s22s22p43s2 | ||
| C. | 1s22s22p63s23p63d54s1 | D. | 1s22s22p63s23p63d34s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫-碘循环分解水制氢主要涉及下列反应:
硫-碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向盛有1mL2%的硝酸银溶液中逐滴加入2%稀氨水,边滴边振荡至最初产生的沉淀恰好消失为止 | 配制少量银氨溶液 |
| B | 向盛有2mL10%的硫酸铜溶液的试管中滴加0.5mL10%氢氧化钠溶液,混合均匀,滴入待检液,加热 | 检验某溶液中是否含有醛基 |
| C | 向淀粉溶液中加入稀硫酸,加热一段时间后,再加入银氨溶液 | 检验淀粉是否水解完全 |
| D | 将氯乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合溶液中滴加硝酸银溶液 | 检验水解产物中的氯离子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L SO3中含有氧原子数目为3NA | |
| B. | 常温常压下,56g铁与足量硫粉反应,转移的电子数目为3NA | |
| C. | 标准状况下,22.4L Cl2溶于足量水中,转移的电子数目为NA | |
| D. | 标准状况下,22.4L NH3溶于水配成1L溶液,其浓度为1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com