
| A. | x的原子半径大于y的原子半径 | |
| B. | x的电负性大于y的电负性 | |
| C. | x的核电荷数大于y的核电荷数 | |
| D. | x的第一电离能小于y 的第一电离能 |
分析 x元素的印离子和y元素的阳离子具有相同的电子层结构,离子核外电子数目相等,则y元素处于x元素的下一周期,x为非金属元素,最外层电子数较多,y为金属元素,最外层电子数相对较少.
解答 解:x元素的印离子和Y元素的阳离子具有相同的电子层结构,离子核外电子数目相等,则y元素处于X元素的下一周期,x为非金属元素,最外层电子数较多,y为金属元素,最外层电子数相对较少,
A.y元素处于x元素的下一周期,x为非金属元素,原子半径小于同周期与y处于同族的元素,故原子半径y>x,故A错误;
B.x为非金属元素,y为金属元素,故x的电负性大于y的电负性,故B正确;
C.y元素处于x元素的下一周期,x的核电荷数小于y的核电荷数,故C错误;
D.x为非金属元素,y为金属元素,故x的第一电离能大于y的第一电离能,故D错误;
故选B.
点评 本题考查结构与位置的关系、半径与电负性、第一电离能比较等,难度不大,关键根据离子具有相同的电子层结构推断元素的相对位置.


科目:高中化学 来源: 题型:选择题
| A. | H2S、H2O、HF的稳定性依次增强 | |
| B. | RbOH、KOH、Mg(OH)2的碱性依次减弱 | |
| C. | Na+、Mg2+、Al3+的氧化性依次减弱 | |
| D. | H2SiO3、H2CO3、H2SO4 酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol NH3溶于足量水中(不考虑氨气挥发),溶液中N原子的数目为0.1NA | |
| B. | 标准状况下,22.4LNO与CO2的混合气体中含有O原子数为3NA | |
| C. | 58.5 g的NaCl固体中含有NA个氯化钠分子 | |
| D. | 0.1molN2与足量的H2反应,转移的电子数是0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| B. | 元素X与氢可形成原子个数比为1:4的化合物 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素Z可与元素X形成化合物XZ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| T/℃ | 400 | 300 |
| 平衡常致K | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
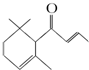 一种从植物中提取的天然化合物adamascone,可用于制作“香水”,其结构如图,有关该化合物的下列说法不正确的是( )
一种从植物中提取的天然化合物adamascone,可用于制作“香水”,其结构如图,有关该化合物的下列说法不正确的是( )| A. | 分子式为C13H18O | |
| B. | 该化合物可发生聚合反应 | |
| C. | 1 mol该化合物完全燃烧消耗18 mol O2 | |
| D. | 与溴的CCl4溶液反应生成的产物经水解、稀硝酸酸化后可用AgNO3溶液检验生成的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于196.64kJ | B. | 等于98.32kJ | C. | 小于196.64kJ | D. | 大于196.64kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com