
| A. | 苯和苯酚 | B. | 甲烷和2,2-二甲基丁烷 | ||
| C. | 乙醇和乙二醇 | D. | 1,1-二氯乙烷和1,2-二氯乙烷 |
分析 结构相似,分子组成上相差1个或者若干个CH2基团的化合物互称为同系物.多用于有机化合物,注意同系物的官能团种类、数目相同.
解答 解:A.苯酚含有羟基,属于酚类,苯属于芳香烃,不含官能团,二者不是同系物,故A错误;
B.甲烷和2,2-二甲基丁烷结构相似,在分子组成上相差5个CH2原子团,属于同系物,故B正确;
C.乙醇分子含有1个-OH,乙二醇分子含有2个-OH,含有官能团数目不相同,不是同系物,故C错误;
D.1,1-二氯乙烷和1,2-二氯乙烷分子式相同,氯原子位置不同,互为同分异构体,故D错误.
故选B.
点评 本题考查同系物的判断,难度不大,注意同系物必须含有官能团相同,且官能团的数目也相同,注意把握概念的内涵与外延.


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 单质常用作半导体材料和光导纤 | B. | 在自然界中以化合态的形式存在 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
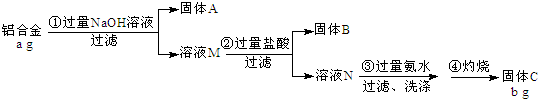
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2mol H2、l mol CO | 1mol CH3OH | 2mol CH3OH | |
| 平 | c(CH,0H)/mol/L | C1 | C2 | c3 |
| 衡 | 反应的能量变化ZkJ | x | y | z |
| 数 | 体系压强/Pa | P1 | P2 | P3 |
| 据 | 反应物转化率 | a1 | a2 | a3 |
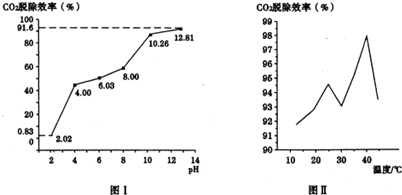
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VIIA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | (10) | (11) | (12) |
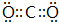
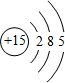 .
.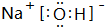 含有化学键为离子键、共价键
含有化学键为离子键、共价键查看答案和解析>>
科目:高中化学 来源: 题型:解答题
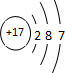 ,元素B在周期表中的位置2周期ⅥA族.
,元素B在周期表中的位置2周期ⅥA族.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 半径:Al3+>Mg2+>Na+>F- | B. | 稳定性:HI<HBr<HCl<HF | ||
| C. | 酸性:HClO4<H2SO4<H3PO4 | D. | 碱性:Al(OH)3>Mg(OH)2>Ca(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com