
����Ŀ���о�ͭ���仯��������ʶԿ��С�������������Ҫ�����壮
��1��ͭ�ɲ������·����Ʊ�
�ٻ���ͭ��Cu2S+O2![]() 2Cu+SO2
2Cu+SO2
��ʪ����ͭ��CuSO4+Fe�TFeSO4+Cu
�������ַ����У�ͭԪ�ؾ��� �����������ԭ������ͭ���ʣ����âٷ�ÿ�Ƶ�32gCu��ת�Ƶ��ӵ����ʵ����� ��
��2���ڳ�ʪ�Ŀ�����ͭ���Է����绯ѧ��ʴ������ͭ�̣�ͭ�̵Ļ�ѧʽΪ ������ʴ��������ӦʽΪ�� ����ͭ��п��ɵĻ�ͭ�Ͻ������⣬�����ʴ�ķ����� ��
��3����Li����CuO����ܷ�ӦΪ��2Li+CuO�TLi2O+Cu���������ҺΪ��������л���Һ����ص�������ӦʽΪ�� ����
��Cu2O��һ�ְ뵼����ϣ����ڼ�����Һ���õ�ⷨ��ȡ������ܷ�ӦʽΪ��
2Cu+H2O![]() Cu2O+H2����������ӦʽΪ�� ����Cu2OͶ��ϡ�����У��õ���ɫ��Һ�ͺ�ɫ������д���÷�Ӧ�����ӷ���ʽ�� ��
Cu2O+H2����������ӦʽΪ�� ����Cu2OͶ��ϡ�����У��õ���ɫ��Һ�ͺ�ɫ������д���÷�Ӧ�����ӷ���ʽ�� ��
��4��Ϊ�˻��մ�ͭ�������������е�Ag��Au��ijʵ��С��������й��������±���
��� | �����·�Ӧ | ��ѧƽ�ⳣ�� |
��Ӧ�� | Au+6HNO3Au��NO3��3+3NO2��+3H2O | ��10��5 |
��Ӧ�� | Au3++4Cl��[AuCl4]�� | ��105 |
�������п�֪�������½���������ᷴӦ����ȴ��������ˮ��Ũ������Ũ���������Ϊl��3�Ļ������������û�ѧƽ���ƶ�ԭ������Ҫ˵������������ˮ��ԭ�� ��
���𰸡���ԭ��1.5mol��Cu2��OH��2CO3��Cu2��OH��2CO3��O2+2H2O+4e��=4OH��������������������CuO+2e��+2Li+=Li2O+Cu��2Cu��2e��+2OH��=Cu2O+H2O��Cu2O+2H+=Cu2++Cu+H2O��Ũ���Ậ�д��������ӣ�Au3+�������������γ��ȶ���[AuCl4]�����ӣ�ʹ��Ӧ��ƽ�������ƶ�����Au������ˮ��
����������1��������Ӧ��CuԪ�ػ��ϼ���+2�ۻ�+2��ת��Ϊ0�ۣ�������ԭ��Ӧ������CuԪ�ر���ԭ�����âٷ�ÿ�Ƶ�32gCu��n��Cu��=![]() =0.5mol����Ҫ����ͭ�����ʵ���Ϊ0.25mol��ת�Ƶ��ӵ����ʵ���=0.25mol��[4������2��]=1.5mol��
=0.5mol����Ҫ����ͭ�����ʵ���Ϊ0.25mol��ת�Ƶ��ӵ����ʵ���=0.25mol��[4������2��]=1.5mol��
���Դ��ǣ���ԭ�� 1.5mol��
��2��Cu��������������̼��ˮ��Ӧ����Cu2��OH��2CO3 �� ����ͭ�̵Ļ�ѧʽΪCu2��OH��2CO3 �� �����������õ��Ӻ�ˮ��Ӧ�������������ӣ��缫��ӦʽΪO2+2H2O+4e��=4OH����Zn��Cu�͵���ʹ���ԭ��أ�Zn��ʧ���Ӷ���������Cu���������������������÷���Ϊ�������������������Դ��ǣ�
Cu2��OH��2CO3��O2+2H2O+4e��=4OH��������������������
��3����������CuO�õ��ӷ�����ԭ��Ӧ���缫��ӦʽΪCuO+2e��+2Li+=Li2O+Cu�����Դ��ǣ�CuO+2e��+2Li+=Li2O+Cu��
��������ͭʧ���Ӻ����������ӷ�Ӧ����������ͭ��ˮ���缫��ӦʽΪ2Cu��2e��+2OH��=Cu2O+H2O��������ͭ��ϡ���ᷴӦ��������ͭ��Cu��ˮ�����ӷ���ʽΪCu2O+2H+=Cu2++Cu+H2O�����Դ��ǣ�2Cu��2e��+2OH��=Cu2O+H2O�� Cu2O+2H+=Cu2++Cu+H2O��
��4��Ũ���Ậ�д��������ӣ�Au3+�������������γ��ȶ���[AuCl4]�����ӣ�ʹ��Ӧ��ƽ�������ƶ�����Au������ˮ�У����Դ��ǣ�Ũ���Ậ�д��������ӣ�Au3+�������������γ��ȶ���[AuCl4]�����ӣ�ʹ��Ӧ��ƽ�������ƶ�����Au������ˮ�У�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ƾ��壨 Na2MoO42H2O����һ����������ȴˮϵͳ�Ľ�����ʴ������ҵ�������⾫����Ҫ�ɷ��Dz�����ˮ��MoS2���Ʊ������Ƶ�����;����ͼ1��ʾ��
��1��NaClO�ĵ���ʽ�� ��
��2��Ϊ����߱���Ч�ʣ����������������Բ��õĴ�ʩ�� ��
��3��;��I���ʱ������Ӧ�����ӷ���ʽΪ ��
��4��;��������ʱ������Ӧ�����ӷ���ʽΪ ��
��5�������ƺ��¹���������Ļ��Һ����Ϊ̼�ظֵĻ�ʴ���������£�̼�ظ������ֲ�ͬ�����еĸ�ʴ����ʵ������ͼ2��
��Ҫʹ̼�ظֵĻ�ʴЧ�����ţ������ƺ��¹����������Ũ�ȱ�ӦΪ ��
�ڵ������Ũ�ȴ���90%ʱ����ʴ���ʼ���Ϊ�㣬ԭ���� ��
���Է����������������Ũ�ȵ�����̼�ظ��������и�ʴ���ʲ������Բ������Ҫԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʽ�ζ���ȷ��ȡ10.00mLijδ֪Ũ�ȵ���������һ�ྻ����ƿ�У�Ȼ����0.20molL ��1������������Һ��ָʾ��Ϊ��̪�����ζ�������£�
NaOH��ʼ���� | NaOH�յ���� | |
��һ�� | 0.50mL | 18.60mL |
�ڶ��� | 0.70mL | 19.00mL |
��1�������������ݿ��Լ������������ʵ���Ũ��ΪmolL��1 ��
��2���ﵽ�ζ��յ�ı�־�� ��
��3�����²�����ɲⶨ���ƫ�ߵ�ԭ������� �� A��δ�ñ�Һ��ϴ��ʽ�ζ���
B���ζ��յ����ʱ�����ӵζ��ܵĿ̶ȣ�������������ȷ
C��ʢװδ֪Һ����ƿ������ˮϴ����δ�ô���Һ��ϴ
D���ζ����յ����ʱ���ֵζ��ܼ��촦����һ����Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ַ�������Ƶð�ɫ��Fe(OH)2������
����һ���ò���Fe3+��FeSO4��Һ�벻��O2������ˮ���Ƶ�NaOH��Һ��Ӧ�Ʊ���
��1����ȡ�����FeSO4��Һ��Ҫ�ķ�Ӧ��Ϊ_______��
��2�����ɰ�ɫFe(OH)2�����IJ������ó��ι���ȡNaOH��Һ������FeSO4��ҺҺ���£��ټ���NaOH��Һ������������������__________��
������������ͼ��ʾ��װ���У���NaOH��Һ����м��ϡH2SO4���Լ��Ʊ���
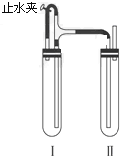
��3�����Թ����������Լ���________________________________________��
��4�����Թ����������Լ���________________________________________��
�������ȴ�ֹˮ�У�ʹI���з�Ӧһ��ʱ����ټн�ֹˮ�У�ʵ���й۲쵽I������Һ��ѹ��II���У�II�з�����Ӧ�����ӷ���ʽΪ��_____________��
��5���������ɵ�Fe(OH)2�����ܽϳ�ʱ�䱣�ְ�ɫ����������_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����xmL pH=a��ϡNaOH��Һ��ymL pH=b��ϡ�����ַ�Ӧ�����й��ڷ�Ӧ����ҺpH���жϣ���ȷ���ǣ� ��
A.��x=y����a+b=14����pH��7
B.��10x=y����a+b=13����pH=7
C.��ax=by����a+b=13����pH=7
D.��x=10y����a+b=14����pH��7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʷֱ������ˮ�У���ˮ����ɫ�������仯���ǣ� ��
A.NaI����
B.KCl����
C.CCl4Һ��
D.NaOH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���δ�������ҽѧ���δȡ�ϴԩ��¼�������������鶾���ļ��أ��������鶾����ԭ���ǣ�4Ag + 2H2S + O2![]() 2X����ɫ��+ 2H2O������˵����������ȷ����
2X����ɫ��+ 2H2O������˵����������ȷ����
A. �����鶾ʱ�������е������õ�����
B. ÿ����1molX����Ӧת��2mole-
C. �������ͻ�ԭ�������ʵ���֮��Ϊ1: 4
D. ��Ӧ��Ag��H2S��Ϊ��ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����K2Cr2O7 + 14HCl (Ũ) =2KCl + 2CrCl3 +3Cl2��+7H2O����0.1molK2Cr2O7��Ӧʱ����֪
A��1.4mol HCl������ B��ת�Ƶ�����1.806��1023
C����������Ϊ0.3mol D����ԭ����ΪKCl
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com