
| A、欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2悬浊液并加热 |
| B、除去苯中少量的苯酚,加溴水,振荡,过滤出去沉淀 |
| C、在鸡蛋清溶液中分别加入饱和NaSO4、CuSO4溶液,都会因盐析而产生沉淀 |
| D、实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰再蒸馏的方法 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、石墨比金刚石稳定 |
| B、金刚石比石墨稳定 |
| C、石墨转化为金刚石是一个物理变化 |
| D、石墨和金刚石是同一种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、168g | B、42g |
| C、126g | D、60g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在硅酸钠溶液中滴入稀盐酸,溶液变浑浊,说明Cl元素的非金属性强于Si元素 |
| B、Zn与稀硫酸反应时,滴加少量CuSO4溶液,反应速率加快,说明CuSO4在该反应中起催化剂作用 |
| C、用酚酞作指示剂,盐酸滴定Na2CO3溶液,达到滴定终点时,离子浓度关系为:c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D、将NaAlO2溶液与NaHCO3溶液混合,出现白色沉淀,是两种溶液水解相互促进的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D是前四周期原予序数依次增大的四种元素,其中A和B原子的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;C和D与B位于同一周期,C和D的价电子层中的未成对电子数分别为4和2,且原子序数相差为2.
A、B、C、D是前四周期原予序数依次增大的四种元素,其中A和B原子的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;C和D与B位于同一周期,C和D的价电子层中的未成对电子数分别为4和2,且原子序数相差为2.查看答案和解析>>
科目:高中化学 来源: 题型:
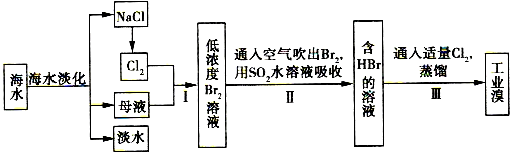
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(SO2) |
| c(SO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com