
运用元素周期律分析下面的推断,其中不正确的是( )
|
| A. | 锂(Li)与水反应比钠与水反应剧烈 |
|
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 |
|
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 |
|
| D. | HBrO4的酸性比HIO4的酸性强 |
考点:
同一主族内元素性质递变规律与原子结构的关系;元素周期律的作用.
专题:
元素周期律与元素周期表专题.
分析:
A.元素的金属性越强,对应的单质与水反应越剧烈;
B.根据同主族元素的性质相似性分析;
C.根据同主族元素的性质的相似性和递变性分析;
D.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强.
解答:
解:A.金属性:Na>Li,元素的金属性越强,对应的单质与水反应越剧烈,则钠与水反应比锂与水反应剧烈,故A错误;
B.卤族元素的单质从上到下颜色逐渐加深,则砹(At)为有色固体,卤族元素单质的卤化银都不溶于水也不溶于硝酸,故B正确;
C.碱金属元素从上到下元素的金属性逐渐增强,对应的单质与氧气反应的产物有氧化物、过氧化物、超氧化物等,越来越复杂,故C正确;
D.非金属性:Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则HBrO4的酸性比HIO4的酸性强,故D正确.
故选A.
点评:
本题考查同主族元素的性质的相似性和递变性,题目难度不大,注意把握元素周期律的递变性和相似性.


 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
|
| A. | 常温下,4.48L N2和O2的混合气体中所含原子数为0.4NA |
|
| B. | 常温下,1.0L1.0mol•L﹣1 NaAlO2溶液中含有的氧原子数为2NA |
|
| C. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
|
| D. | 0.1mol Fe参加氧化还原反应,转移的电子数目一定是0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是()
A. 1 mol氯气参加氧化还原反应,转移的电子数一定为2NA
B. 常温常压下,由6 g NO2和40 g N2O4组成的混合气体中原子总数为3NA
C. 0.1 mol•L﹣1 NaF溶液中,HF和F﹣总和为0.1NA个
D. 12.5 mL 16 mol•L﹣1浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
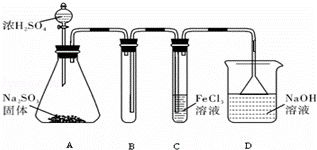
某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去).
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在 中,再加水稀释,这样操作的目的是 ,操作中不需要的仪器有 (填字母).
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时C中观察到的现象为 ,
(3)根据以上现象,该小组同学认为SO2 与 FeCl3溶液发生氧化还原反应.
①写出SO2与FeCl3溶液反应的离子方程式 ;
②请设计实验方案检验有Fe2+生成取 ;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42﹣.该做法 (填“合理”或“不合理”),理由是 .
(4)D装置中倒置漏斗的作用是 .
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有 (填入正确选项前的字母).
a.浓H2SO4 b.酸性KMnO4溶液 c.碘水 d.NaCl溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
关于元素周期表的下列叙述,错误的是( )
|
| A. | 元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一 |
|
| B. | 在周期表中,把电子层数相同的元素排成一横行,称为一周期 |
|
| C. | 元素周期表中,总共有18个纵行,18个族 |
|
| D. | 第IA族的元素又称为碱金属元素(除了H),第VIIA族的元素又称为卤族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)原子序数11~17的元素,自钠到氯,电子层数相同,最外层电子数从 增加到 ,随着核电荷数依次递增,原子半径依次 ,核对外层电子的引力逐渐 ,失电子能力逐渐 ,得电子能力逐渐 ,因此,金属性逐渐 ,非金属性逐渐 .
(2)元素金属性的强弱,可以从它的单质与水或酸的反应置换氢的 程度,以及它的最高价氧化物的水化物的 强弱来判断.元素非金属性的强弱,可以从它的最高价氧化物的水化物的 强弱,或它的单质跟氢气生成气态氢化物的 及氢化物的 来判断.
(3)元素的性质随着原子序数的递增而呈 的变化,这个规律叫做元素周期律.
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用改进汽油组成的办法来改善汽油的燃烧性能,例如:加入CH3OC(CH3)3来生产无铅汽油.CH3OC(CH3)3分子中必存在的原子间连接形式是( )
A. 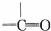 B.
B. 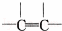 C.
C. 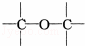 D.
D. 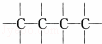
查看答案和解析>>
科目:高中化学 来源: 题型:
A和B在一定条件下可合成芳香族化合物E,G在标准状况下是气体,此情况下的密度为1.25g/L.各物质间相互转化关系如下所示:
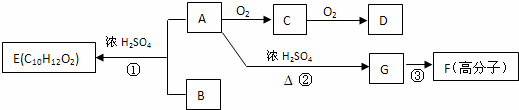
请回答下列问题:
(1)G中的官能团是 (用化学式表示),D中的官能团名称是 ,F的结构简式 .
(2)指出反应类型:① ,② ,③ .
(3)满足下列条件的B的同分异构体有 种.
①遇FeCl3溶液显紫色 ②能发生银镜反应 ③苯环上只有两个取代基
(4)写出化学方程式:A→C ;
C与新制的氢氧化铜悬浊液反应: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com