
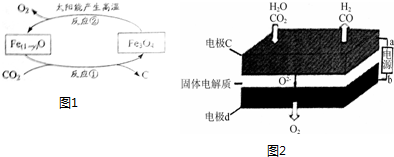
分析 (1)依据热化学方程式 和盖斯定律计算分析判断;
(2)从熵变和焓变判断反应的自发性,该反应是气体体积增大的吸热反应,为提高CO的产率,依据化学平衡移动原理分析判断;
(3)①由题意吸收低浓度的CO2,则应生成正盐(NH4)2CO3 ;
②依据图1反应物和产物利用直平法配平化学方程式,利用已知守恒计算得到;
③二氧化碳、水分别在a极得到电子发生还原反应生成一氧化碳、氢气,同时生成氧离子;电极b氧离子失去电子发生氧化反应生成氧气,根据电极反应式可得电解得到1:1的合成气(CO+H2)通入的CO2和H2O物质的量之比.
解答 解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1
由盖斯定律$\frac{①}{3}$-$\frac{②}{3}$得到C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1,
故答案为:+172.5;
(2)由题第一步:2CH3OH(g)?HCOOCH3(g)+2H2(g);第二步:HCOOCH3(g)?CH3OH(g)+CO(g),两反应均为气体体积增大的反应,则两反应都△S>0,常温下不能自发,故△H>0,第二步:HCOOCH3(g)?CH3OH(g)+CO(g)△H>0,反应是气体体积增大的吸热反应,依据平衡移动原理可知提高一氧化碳产率,应使平衡正向进行,升温,减压实现,
故答案为:两反应都△S>0,常温下不能自发,故△H>0;升高反应温度或减小压强;
(3)①由题意吸收低浓度的CO2,则应生成正盐(NH4)2CO3 ,
故答案为:2NH3.H2O+CO2=(NH4)2CO3+H2O;
②依据图示得到化学方程式为:$\frac{(1-y)}{3}$Fe3O4=Fe(1-y)O+xO2,依据氧原子守恒得到x=$\frac{1-4y}{6}$,
故答案为:$\frac{1-4y}{6}$;
③二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,水中的氢元素化合价降低被还原,电极反应式为:H2O+2e-=H2+O2-,根据电极反应式可得电解得到1:1的合成气(CO+H2)通入的CO2和H2O物质的量之比为1:1;
故答案为:CO2+2e-═CO+O2-;H2O+2e-=H2+O2-;1:1.
点评 本题考查了盖斯定律的应用、化学平衡移动原理的应用,电解池电极反应的分析书写,原子守恒氧化还原反应的计算应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 3.6g | B. | 1.8g | C. | 7.2g | D. | 4.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯水不导电,所以水不是电解质 | |
| B. | SO3水溶液的导电性很强,所以SO3是电解质 | |
| C. | 液态的铜导电性很好,所以铜是电解质 | |
| D. | Na2O液态时能导电,所以Na2O是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| A | A元素的原子半径比B元素的原子半径大 | 周期表中A位于B的下一周期 |
| B | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| C | 常温下,铜能与浓硝酸反应而铝被浓硝酸钝化 | 还原性:Cu>Al |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃20mL 3mol/L的X溶液 | B. | 20℃30mL 2mol/L的X溶液 | ||
| C. | 20℃10mL 4mol/L的X溶液 | D. | 10℃10mL 2mol/L的X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 服用阿司匹林过量出现水杨酸(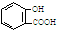 )中毒反应,可静脉注射NaHCO3溶液: )中毒反应,可静脉注射NaHCO3溶液: | |
| B. | 甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | H2 | CO | CH4 |
| 燃烧热(kJ•mol-1) | 285.8 | 283.0 | 890.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B
,B ,C
,C ,D
,D .它们离子的半径由大到小的顺序r(S2-)>r(Cl-)>r(K+)>r(Ca2+).
.它们离子的半径由大到小的顺序r(S2-)>r(Cl-)>r(K+)>r(Ca2+).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于10种 | B. | 10种 | C. | 6种 | D. | 5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com