
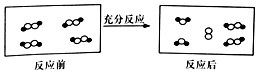
 一定条件下,某容器中各微粒在反应前后变化的示意图如图,其中•和○代表不同元素的原子.关于此反应说法正确的是( )
一定条件下,某容器中各微粒在反应前后变化的示意图如图,其中•和○代表不同元素的原子.关于此反应说法正确的是( )| A. | 属于化合反应 | B. | 属于置换反应 | ||
| C. | 属于氧化还原反应 | D. | 属于复分解反应 |
分析 由图可知,反应前的4个分子中只有2个分子发生变化,可为2分子H2O2分解生成1分子O2和2分子H2O,只有共价键的断裂和生成,以此来解答.
解答 解:A、过氧化氢分解生成氧气和水是分解反应,故A错误;
B、过氧化氢分解生成氧气和水是分解反应,不是置换反应,故B错误;
C、过氧化氢分解生成氧气和水是分解反应,属于氧化还原反应,故C正确;
D、过氧化氢分解生成氧气和水是分解反应,而不是复分解反应,故D错误;
故选C.
点评 本题考查化学反应、共价键、可逆反应等,为高频考点,把握图中分子的变化、常见的反应为解答的关键,侧重分析与应用能力的考查,注意判断参加反应的分子数目,题目难度不大.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 水电离出的c(OH-):①>②>④>③ | |
| B. | ①和③混合后溶液呈中性:c(Na+)+c(H+)>c(CH3COO-)+c(Cl-) | |
| C. | ①和④混合后溶液呈酸性:$\frac{c(N{a}^{+})}{c(C{H}_{3}CO{O}^{-})}$=1 | |
| D. | ③和④分别稀释100倍后的pH④<③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
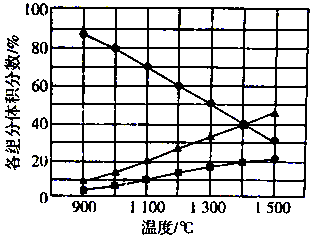 H2S在高温下分解生成硫蒸气(S2)和H2,不同温度下,反应体系中各组分的体积分数如图所示.则1400℃时反应体系中混合气体的平均摩尔质量为( )
H2S在高温下分解生成硫蒸气(S2)和H2,不同温度下,反应体系中各组分的体积分数如图所示.则1400℃时反应体系中混合气体的平均摩尔质量为( )| A. | 20.8g/mol | B. | 27.2 g/mol | C. | 33.3 g/mol | D. | 39.6 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液溴易挥发,在存放液溴的试剂瓶中应加水封 | |
| B. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32- | |
| C. | 向某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I- | |
| D. | 加入稀盐酸酸化的AgNO3溶液,产生白色沉淀,则原溶液中一定含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙溶于稀盐酸中:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 少量的金属铜加入到FeCl3溶液中:Fe3++Cu═Fe2++Cu2+ | |
| C. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| D. | 将少量NaOH溶液与足量Ba(HCO3)2溶液混合:Ba2++2HCO3-+2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
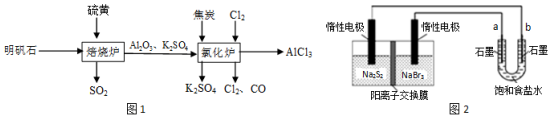
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com