
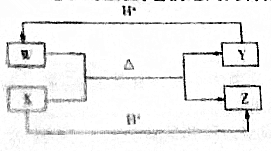
| A. | W的电子式为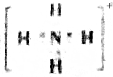 | |
| B. | Y与Z之间可形成氢键 | |
| C. | 硫酸与氢氧化钠溶液反应的离子方程式可表示为X+H+=Z | |
| D. | 微粒Y中各元素原子均达到8电子稳定结构 |
分析 10电子微粒:
一核:Ne、N3-、O2-、F-、Na+、Mg2+、Al3+
二核:HF、OH-
三核:H2O、NH2-
四核:NH3、H3O+
五核:CH4、NH4+,如果W、X、Y、Z均是10电子的微粒,发生反应W+X$\frac{\underline{\;\;△\;\;}}{\;}$Y+Z,依据10电子结构判断X为OH-,Z为H2O、Y为NH3、W为NH4+,由此分析解答.
解答 解:A、铵根离子的电子式为: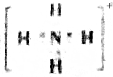 ,故A正确;
,故A正确;
B、氨气与水分子间能形成氢键,故B正确;
C、硫酸与氢氧化钠溶液反应的离子反应,即是氢离子与氢氧根离子反应,而X为OH-,Z为H2O、所以X+H+=Z,故C正确;
D、Y为NH3,氨气中氮达8电子的稳定结构,而氢是2电子结构,故D错误;
故选D.
点评 本题考查了10电子微粒的分析应用,注意反应特征的理解判断,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若不考虑HClO和H20的电离,该溶液中H+的浓度为0.1mol/L | |
| B. | 若在该溶液中加入足量Na0H,则可得到0.1mol的NaClO | |
| C. | 若将此溶液在强光下光照,产生气泡,则气泡主要成分是O2 | |
| D. | 此溶液久置后,由于HClO的大量分解,会导致其pH值升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放一大盆水于室内 | B. | 放一大盆苯于室内加以溶解吸收 | ||
| C. | 洒一些酸性KMnO4溶液于地面 | D. | 打开窗户,长时间通风 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
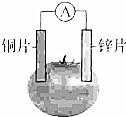 甲乙两位同学一起做水果电池的实验,测得数据如下:
甲乙两位同学一起做水果电池的实验,测得数据如下:| 试验编号 | 电极材料 | 水果品种 | 电极间距/cm | 电压/mV | |
| 1 | 锌 | 铜 | 菠萝 | 3 | 900 |
| 2 | 锌 | 铜 | 苹果 | 3 | 650 |
| 3 | 锌 | 铜 | 柑桔 | 3 | 850 |
| 4 | 锌 | 铜 | 西红柿 | 3 | 750 |
| 5 | 锌 | 铝 | 菠萝 | 3 | 650 |
| 6 | 锌 | 铝 | 苹果 | 3 | 450 |
| A. | ③ | B. | ① | C. | ①②③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
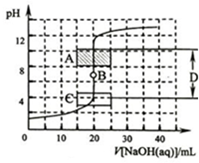 酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的试验方法.例如用一定浓度的氢氧化钠溶液滴定一定浓度的盐酸,其间溶液的pH变化是判断滴定终点的依据.
酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的试验方法.例如用一定浓度的氢氧化钠溶液滴定一定浓度的盐酸,其间溶液的pH变化是判断滴定终点的依据.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
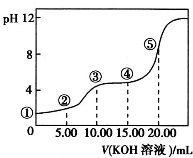
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH<7的溶液是酸的溶液 | |
| B. | pH>7的溶液是碱的溶液 | |
| C. | pH>7的溶液有可能是盐的溶液,这是因为盐可能电离出H+ | |
| D. | pH>7的溶液有可能是盐的溶液,这是盐类水解造成的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com