
 如图为A(气)+B(气)?nC(气)+Q在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )
如图为A(气)+B(气)?nC(气)+Q在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )| A. | 若其它条件相同,a比b的温度高 | |
| B. | a表示有催化剂,b表示无催化剂 | |
| C. | 若n=2,其它条件相同,a比b的压强大 | |
| D. | 反应由逆反应开始 |
分析 A、温度高,到达平衡时间短,再根据升温,平衡移动分析;
B、加入催化剂同等程度增大正逆反应速率,平衡不移动;
C、压强越大到达平衡时间短,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应;
D、从C的百分含量的变化判断.
解答 解:A、a到达平衡时间短,所以a温度高,升温平衡时C的百分含量(C%)减小,平衡逆向移动,所以△H<0,故A正确;
B、加入催化剂同等程度增大正逆反应速率,平衡不移动,则a、b到达平衡时C的百分含量相同,故B错误;
C、a到达平衡时间短,所以a压强高,压强越大,平衡时C的百分含量(C%)越小,可知正反应为气体物质的量增大的反应,所以n>2,故C错误;
D、C的百分含量从零开始逐渐增大,所以反应从正反应开始,故D错误;
故选A.
点评 本题考查了外界条件对速率和平衡的影响,难度不大,明确“先拐先平数值大”是解本题的关键,注意把握温度、压强、催化剂对速率及平衡的影响.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:解答题
 常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:
常用于除去高速公路冰雪的是“氯盐类”融雪剂,如NaCl、MgCl2等,请回答:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤①③⑥ | B. | ⑤②④①③⑥ | C. | ④②⑤①③⑥ | D. | ②⑤④③①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 | |
| B. | 用水鉴别己烷、四氯化碳、酒精三种无色液体 | |
| C. | 将苯和溴水混合制取溴苯 | |
| D. | 可用酸性高锰酸钾溶液鉴别甲烷和乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .B存在同素异形现象,其中常用作消毒剂的是O3.(填化学式)
.B存在同素异形现象,其中常用作消毒剂的是O3.(填化学式) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
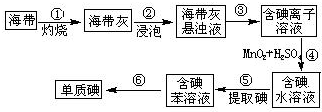 碘在工农业生产和日常生活中有重要用途.
碘在工农业生产和日常生活中有重要用途.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com