
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素的性质或原子结构 |
T | M层上的电子数是其原子核外电子层数的2倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下,单质为双原子分子,其氢化物的水溶液呈碱性 |
Z | 元素的最高正化合价是+7 |
(1)元素T在元素周期表中的位置是第________周期第________族。
(2)元素X的一种同位素可测定文物的年代,这种同位素的符号是________。
(3)元素Y与氢元素形成一种分子YH3,该分子的化学式为____________________。
(4)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下,Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下,Z和T的单质都能与NaOH溶液反应
(5)T、X、Z三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序是______________(用化学式表示)。
【答案】三 ⅥA ![]() C NH3 Cl b HClO4>H2SO4>H2CO3
C NH3 Cl b HClO4>H2SO4>H2CO3
【解析】
T的M层上的电子数是原子核外电子层数的2倍,应为S元素;X最外层电子数是次外层的2倍,因此X次外层为2个电子,最外层为4个电子,是C元素;Y单质是双原子分子,且其氢化物水溶液显碱性,可知Y是N元素;元素Z最高正价是+7价,因此Z是Cl,据此分析结合元素性质解答。
(1)T为S元素,S元素在元素周期表的第三周期、第ⅥA族;
(2)X是C元素,碳元素的质子数为6,中子数为8,则质量数为6+8=14,故同位素的元素符号为:![]() C;
C;
(3)Y是N元素,氮元素与氢元素形成的分子为氨气,其化学式为NH3;
(4)Z是Cl,T为S元素,同周期元素,随核电荷数增大,非金属性越强,Cl元素与S元素相比,Cl元素的非金属性更强,
a.Z的单质和T的单质状态不同,状态属于物理性质,不能比较非金属性强弱,故a错误;
b.非金属性越强,则元素对应气态氢化物的稳定性越强,故b正确;
c.Z和T的单质都能与NaOH溶液反应,不能比较非金属性强弱,故c错误;
故选b;
(5)T为S元素,X是C元素,Z是Cl元素,元素非金属性越强则最高价氧化物对应的水化物的酸性越强,非金属性:Cl>S>C,因此最高价氧化物对应水化物的酸性由强到弱的顺序是:HClO4>H2SO4>H2CO3。


科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生实验小组用50mL 1.0mol·L-1的盐酸与50mL 1.1mol·L-1的NaOH溶液在如图所示的装置中进行中和反应反应热的测定。
(1)图中装置缺少的一种仪器,该仪器名称为_________。
(2)如果改用60mL 1.Omol·L-1盐酸跟50mL 1.1mol·L—1氢氧化钠溶液进行反应,则与上述实验相比,所放热量____________(填“增加” “减少”或“不变”),所求中和热数值 ________ (填“增加”“减少”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有色金属行业发展蕴藏着巨大潜力。目前,全世界消费量排在前五位为铜、铝、铅、锌、镍。
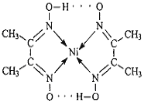
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于___晶体;基态Ni原子的价电子电子排布式为____。
(2)铜原子的电子占有____种能量不同的原子轨道。
(3)配合物分子内(如图)的作用力有_____(填编号)。
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(4)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如 ①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
、④HCHO等,其中分子中C原子为SP2杂化的有____(填物质序号),预测HCHO分子的立体结构为_____形。
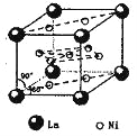
(5)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为______。
(6)邻羟基苯甲醛的沸点____(填大于,小于或等于)对羟基苯甲醛的沸点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z均为元素周期表中前20号元素,X和Z位于同一周期,Y的阳离子和Z的阴离子的核外电子排布相同,Y2Z2与H2Z或XZ2反应都能生成单质气体Z2。
(1)写出元素名称:X________,Y________,Z________。
(2)写出下列物质的电子式:Y2Z2__________________,XZ2__________________。
(3)用电子式表示Y2Z的形成过程:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
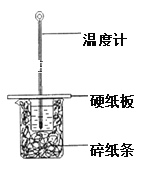
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴水(表面覆盖少量水)。请填写下列空白:
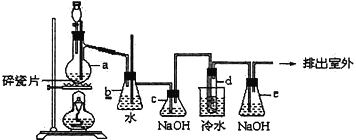
(1)图中碎瓷片的作用是_________________________,若在反应过程中发现未加碎瓷片,应该_____________________________。
(2)烧瓶a中温度计的作用是___________________,该反应是乙醇的脱水反应,即消去反应,反应温度是170℃,并且该反应要求温度迅速高到170℃,否则容易产生副反应。请你写出该副反应的反应方程式:_______________________________。
(3)写出制备1, 2-二溴乙烷的化学方程式:_______________________________。
(4)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:_______________________________。
(5)容器c中NaOH溶液的作用是:_______________________________。
(6)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因_________________________。
(7)e装置内NaOH溶液的作用是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在乙醇的化学性质中,各反应的断键方式可概括如图:
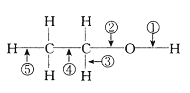
用序号填空:
(1)消去反应的断键位置是___________,化学方程式为________________。
(2)与金属Na反应的断键位置是___________,化学方程为________________。
(3)催化氧化的断键位置是________________,化学方程为_______________。
(4)分子间脱水的断键位置是___________,化学方程为________________。
(5)与HBr反应的断键位置是_______________,化学方程为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据要求回答下列问题:
①干冰与 CO2;②白磷与红磷;③3517Cl 与3717Cl;④液氯与氯水;⑤![]() 与
与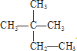 。
。
在上述各组物质中:
互为同位素的是_____________________;
互为同素异形体的是 ______________,
互为同分异构体的是________________;
属于同种物质的是____________________。(填序号,下同)
(2)现有以下六种物质形成的晶体:a.NH4Cl;b.SiO2;c.Na2O2;d.干冰;e.C60;f.Ne
请用相应字母填空:
属于分子晶体的是________; 属于共价化合物的是______________;熔化时只需要破坏共价键的是___; 既含有离子键又含有共价键的是_________; 不存在化学键的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,下列溶液中微粒的物质的量浓度关系正确的是( )
A. 0.1mol/L![]() 与0.1mol/L HCl等体积混合:
与0.1mol/L HCl等体积混合:![]()
B. 0.1mol/L的![]() 溶液,其pH=4,则
溶液,其pH=4,则![]()
C. ![]() 溶液:
溶液:![]()
D. 将0.1mol/L的![]() 溶液和0.1mol/L
溶液和0.1mol/L![]() 溶液等体积混合后,则:
溶液等体积混合后,则:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com