
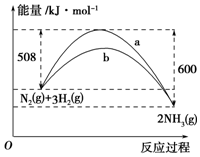
 如图是某温度下,N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式为N2(s)+3H2(g)?2NH3(g)△H=-92 kJ/mola、b两条曲线产生区别的原因很可能是a不适用催化剂,b使用了催化剂.
如图是某温度下,N2与H2反应过程中能量变化的曲线图.该反应的热化学方程式为N2(s)+3H2(g)?2NH3(g)△H=-92 kJ/mola、b两条曲线产生区别的原因很可能是a不适用催化剂,b使用了催化剂. 分析 该反应放出的能量大于吸收的能量,所以放热,△H=放出的能量-吸收的能量=600kJ/mol-508kJ/mol=92kJ/mol,进而书写热化学方程式;其中曲线b是反应的活化能降低了,反应的焓变不变.
解答 解:该反应放出的能量大于吸收的能量,所以放热,△H=放出的能量-吸收的能量=600kJ/mol-508kJ/mol=92kJ/mol,该反应的热化学方程式为:N2(s)+3H2(g)=2NH3(g)△H=-92 kJ/mol,其中曲线b是反应的活化能降低了,反应的焓变不变,所以时加入了催化剂所致.
故答案为:N2(s)+3H2(g)=2NH3(g)△H=-92 kJ/mol;a不适用催化剂,b使用了催化剂.
点评 本题考查反应热与焓变的应用,题目难度中等,根据图象正确计算焓变为解答关键,注意掌握化学反应与能量变化的关系,试题培养了学生的灵活应用能力.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述热化学方程式说明反应物的总键能大于生成物的总键能 | |
| B. | 达平衡后再通入NH3,则平衡正向移动,NH3转化率减小 | |
| C. | 达平衡后升温,则逆反应速率加快,正反应速率减慢,平衡逆向移动 | |
| D. | 达平衡后加入催化剂能同时增大正逆反应速率,平衡发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl是氧化产物 | |
| B. | 每生产1mol Na2Mn5O10转移3mol电子 | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | 正极反应式:Ag+Cl--e-═AgCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题.| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 有机物A的结构简式为
有机物A的结构简式为 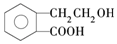 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.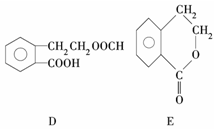
 .
. .
. +2NaOH→
+2NaOH→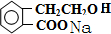 +HCOONa+H2O.
+HCOONa+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
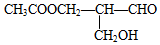 有光学活性,发生下列反应:
有光学活性,发生下列反应:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com