

| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
分析 (1)不能将Na2Cr2O7溶液加到浓硫酸中,因为浓硫酸的密度大,容易发生迸溅;
(2)加入沸石的作用是防止暴沸;
(3)分液漏斗使用前必须进行检漏;
(4)由表中数据可知,正丁醛密度小于水的密度,据此判断;
(5)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(6)设正丁醛的理论产量为xg,根据关系式C4H10O~C4H8O列计算出理论产量,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)因为浓硫酸的密度大,将Na2Cr2O7溶液加到浓硫酸中,容易发生迸溅,
故答案为:不能,容易发生迸溅;
(2)加入沸石的作用是防止暴沸,
故答案为:防止暴沸;冷却后补加;
(3)分液漏斗使用前必须进行检漏,
故选c;
(4)正丁醛密度为0.8017 g•cm-3,小于水的密度,故分层水层在下方,
故答案为:下;
(5)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化,
故答案为:保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(6)设正丁醛的理论产量为xg,根据关系式,
C4H10O~C4H8O
74 72
4g xg
解得:x=$\frac{72×4}{74}$=3.89,所以C4H8O的产率=$\frac{实际产量}{理论产量}$×100%=$\frac{2.0g}{3.89g}$×100%=51.4%,
故答案为:51.4.
点评 本题考查有机化学实验、反应原理、基本操作、化学计算等,难度不大,注意计算中正丁醇的转化率等于正丁醛的产率,注意对基础知识的理解掌握.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4、C2H4、C3H4以任意比混合 | |
| B. | C2H6、C4H6、C2H2以2:1:2的物质的量之比混合 | |
| C. | C3H8、C4H8、C2H2以11:14:26的质量之比混合 | |
| D. | CH4、C3H6、C2H2以a:b:b体积比混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题:
某同学用如图所示装置制取次氯酸钠.图中瓶乙盛饱和食盐水,瓶丙盛浓硫酸,分液漏斗A中盛浓盐酸.试完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | X | Y | Z |
| 初始浓度/mol•L-1 | 0.1 | 0.2 | 0 |
| 2min末浓度/mol•L-1 | 0.08 | a | b |
| 平衡浓度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 平衡时,X的转化率为20% | |
| B. | t℃时,该反应的平衡常数为40 | |
| C. | 前2 min内,用Y的变化量表示的平均反应速率v(Y)=0.03 mol•L-1•min-1 | |
| D. | 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的平衡常数表达式为k=$\frac{{c}^{3}(C)•c(D)}{{c}^{2}(A)•{c}^{3}(B)}$ | |
| B. | 升高温度,该反应的平衡常数增大 | |
| C. | 从反应开始10min,该反应的平均反应速率v(C)为0.12mol/(L•min) | |
| D. | B的平衡转化率为60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,分子中氮原子轨道的杂化类型是sp3.
,分子中氮原子轨道的杂化类型是sp3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤⑥ | B. | ④⑥⑦ | C. | ③④⑦ | D. | 以上都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
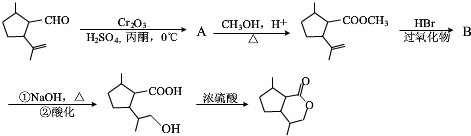
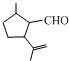 的分子式为C10H16O;其含有的含氧官能团名称是醛基.
的分子式为C10H16O;其含有的含氧官能团名称是醛基.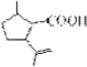 .
. .生成B物质的反应类型为:取代反应.
.生成B物质的反应类型为:取代反应.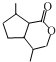 的同分异构体
的同分异构体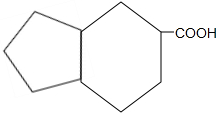 .(任写一种)
.(任写一种)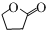 的合成路线图(无机试剂任选),合成路线流程图如下:
的合成路线图(无机试剂任选),合成路线流程图如下: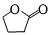
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com