
| A. | 0.5mo1 C2H4 | B. | 11.2L(标准状况) C2H2 气体 | ||
| C. | 23g Na | D. | 9g H2O |
分析 A、分子个数N=nNA;
B、求出乙炔的物质的量,然后根据分子个数N=nNA来求算;
C、求出钠的物质的量,然后根据原子个数N=nNA来求算;
D、求出水的物质的量,然后根据分子个数N=nNA来求算.
解答 解:A、分子个数N=nNA=0.5mol×NA/mol=0.5NA,故A错误;
B、标况下11.2L乙炔的物质的量为0.5mol,故分子个数N=nNA=0.5NA,故B错误;
C、23g钠的物质的量为1mol,故含有的原子个数N=nNA=NA,故C正确;
D、9g水的物质的量为0.5mol,故分子个数N=nNA=0.5NA,故D错误;
故选C.
点评 本题是一道关于物质的量的计算题,注意常见的公式的灵活应用,可以根据教材知识来回答,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

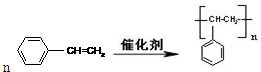 .
.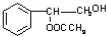 或
或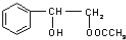 .
.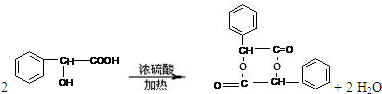 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NO+O2═2NO2 | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 3H2+N2$?_{催化剂}^{高温高压}$3NH3 | D. | NH3+HNO3═NH4NO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不再随时间变化 | |
| B. | 容器内X、Y、Z的浓度之比为:1:2:2 | |
| C. | 单位时间消耗0.1molX,同时生成0.2molY | |
| D. | 单位时间消耗0.1molX,同时生成0.2molZ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔点:Na>Al | B. | 热稳定性NaHCO3>Na2CO3 | ||
| C. | 酸性:H2CO3>H2SiO3 | D. | 氧化性Br2>Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
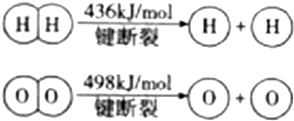
| A. | 该反应原理可用于设计氢氧燃料电池 | |
| B. | 破坏1mol H-O键需要的能量是926.8kJ | |
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+241.8kJ/mol | |
| D. | H2(g)中的H-H键比H2O(g)中的H-O键能小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com