
ij“ż²āŅŗÖŠÖ»æÉÄÜŗ¬ÓŠAg+”¢Fe2+”¢Fe3+”¢Na+”¢Ba2+”¢CO32©”¢NO3©”¢SO42©ÖŠµÄ¼øÖÖĄė×Ó£¬ŅĄ“Ī½ųŠŠČēĻĀŹµŃé£ŗ
¢ŁČ”ÉŁĮæ“ż²āŅŗ£¬¼ÓČė×ćĮæµÄNaClČÜŅŗ£¬ĪŽĆ÷ĻŌĻÖĻó£®
¢Ś¼ĢŠų¼ÓČė×ćĮæµÄNa2SO4ČÜŅŗ£¬ÓŠ°×É«³ĮµķÉś³É£®
¢Ū¹żĀĖ£¬Č”ÉŁĮæĀĖŅŗ£¬¼ÓČė×ćĮæNaOHČÜŅŗ£¬ÓŠ°×É«Šõד³ĮµķÉś³É£¬ŃøĖŁ±ä³É»ŅĀĢÉ«£¬×īÖÕ±ä³ÉŗģŗÖÉ«£®
øł¾ŻŹµŃéĻÖĻó»Ų“š£ŗ
£Ø1£©“ż²āŅŗÖŠŅ»¶Øŗ¬ÓŠĄė×Ó””””£¬Ņ»¶ØƻӊĄė×Ó””””£®
Š“³ö²½Öč¢ŚÖŠ·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½””””£¬Š“³ö²½Öč¢ŪÖŠ³ĮµķÓÉ°×É«±äĪŖŗģŗÖÉ«µÄ»Æѧ·½³ĢŹ½””””£®
æ¼µć£ŗ Ąė×Ó¹²“ęĪŹĢā£»Ąė×Ó·½³ĢŹ½µÄŹéŠ“£®
×ØĢā£ŗ Ąė×Ó·“Ó¦×ØĢā£®
·ÖĪö£ŗ ¢ŁČ”ÉŁĮæ“ż²āŅŗ£¬¼ÓČė×ćĮæµÄNaClČÜŅŗ£¬ĪŽĆ÷ĻŌĻÖĻó£¬ČÜŅŗÖŠŅ»¶Ø²»“ęŌŚŅųĄė×Ó£»
¢Ś¼ĢŠų¼ÓČė×ćĮæµÄNa2SO4ČÜŅŗ£¬ÓŠ°×É«³ĮµķÉś³É£¬ČÜŅŗÖŠŅ»¶Ø“ęŌŚ±µĄė×Ó£¬ŌņŅ»¶Ø²»“ęŌŚĢ¼ĖįøłĄė×ÓŗĶĮņĖįøłĄė×Ó£¬øł¾ŻČÜŅŗµēÖŠŠŌæÉÖŖ£¬ČÜŅŗÖŠŅ»¶Ø“ęŌŚĪØŅ»µÄŅõĄė×ÓĻõĖįøłĄė×Ó£»
¢Ū¹żĀĖ£¬Č”ÉŁĮæĀĖŅŗ£¬¼ÓČė×ćĮæNaOHČÜŅŗ£¬ÓŠ°×É«Šõד³ĮµķÉś³É£¬ŃøĖŁ±ä³É»ŅĀĢÉ«£¬×īÖÕ±ä³ÉŗģŗÖÉ«£¬øĆĻÖĻóĖµĆ÷ČÜŅŗÖŠŅ»¶Ø“ęŌŚŃĒĢśĄė×Ó£¬Ņ»¶Ø²»“ęŌŚĢśĄė×Ó£»
øł¾ŻŅŌÉĻ·ÖĪö½ųŠŠ½ā“š£®
½ā“š£ŗ ½ā£ŗøł¾Ż¢ŁæÉÖŖ£¬ČÜŅŗÖŠŅ»¶Ø²»“ęŌŚAg+Ąė×Ó£»
øł¾Ż¢ŚæÉÖŖ£¬°×É«³ĮµķĪŖĮņĖį±µ£¬ČÜŅŗÖŠŅ»¶Ø“ęŌŚBa2+£¬øł¾ŻĄė×Ó¹²“ę£¬ŌņŅ»¶Ø²»“ęŌŚCO32©”¢SO42©£¬ŌŁøł¾ŻČÜŅŗµēÖŠŠŌæÉÖŖ£¬ČÜŅŗÖŠŅ»¶Ø“ęŌŚNO3©£»
øł¾Ż¢ŪæÉÖŖ£¬ČÜŅŗÖŠŅ»¶Ø“ęŌŚFe2+£¬Ņ»¶Ø²»“ęŌŚFe3+£¬
£Ø1£©øł¾ŻŅŌÉĻ·ÖĪöæÉÖŖ£¬ČÜŅŗÖŠŅ»¶Ø“ęŌŚµÄĄė×ÓĪŖ£ŗFe2+”¢Ba2+”¢NO3©£¬Ņ»¶Ø²»“ęŌŚµÄĄė×ÓĪŖ£ŗAg+”¢Fe3+”¢CO32©”¢SO42©£¬
¹Ź“š°øĪŖ£ŗFe2+”¢Ba2+”¢NO3©£»Ag+”¢Fe3+”¢CO32©”¢SO42©£»
²½Öč¢ŚÖŠ·¢Éś·“Ó¦µÄ·“Ó¦ĪŖĮņĖįøłĄė×ÓÓė±µĄė×Ó·“Ӧɜ³ÉĮņĖį±µ£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗSO42©+Ba2+=BaSO4”ż£»²½Öč¢ŪÖŠ³ĮµķÓÉ°×É«±äĪŖŗģŗÖÉ«£¬ŹĒĒāŃõ»ÆŃĒĢśÓėŃõĘų·“Ӧɜ³ÉĒāŃõ»ÆĢśµÄ·“Ó¦£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½£ŗ4Fe£ØOH£©2+O2+2H2O=4Fe£ØOH£©3£¬
¹Ź“š°øĪŖ£ŗSO42©+Ba2+=BaSO4”ż£»4Fe£ØOH£©2+O2+2H2O=4Fe£ØOH£©3£®
µćĘĄ£ŗ ±¾Ģāæ¼²éĮĖĄė×ÓĶʶĻ£¬³£¼ūĄė×ӵļģŃ飬ĢāÄæÄѶČÖŠµČ£¬×¢ŅāÕĘĪÕĄė×Ó·“Ó¦·¢ÉśĢõ¼ž£¬Ć÷Č·³£¼ūĄė×ӵļģŃé·½·Ø£¬ŹŌĢāÅąŃųĮĖѧɜµÄ·ÖĪö”¢Ąķ½āÄÜĮ¦£®
””


 Ńō¹āŹŌ¾ķµ„ŌŖ²āŹŌ¾ķĻµĮŠ“š°ø
Ńō¹āŹŌ¾ķµ„ŌŖ²āŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
¾ßÓŠĻĀĮŠµē×ÓÅŲ¼Ź½µÄŌ×ÓÖŠ£¬Ō×Ó°ė¾¶×ī“óµÄŹĒ£Ø£©
A£® 1s22s22p63s23p2 B£® 1s22s22p63s2
C£® 1s22s22p2 D£® 1s22s22p63s23p4
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ÓŠŅ»¹ĢĢå»ģŗĻĪļ£¬æÉÄÜÓÉNa2CO3”¢Na2SO4”¢CuSO4”¢CaCl2”¢NaCl»ģŗĻ¶ų³É£®ĪŖ¼ģŃéĖüĆĒµÄ×é³É£¬×öĮĖŅŌĻĀŹµŃé£ŗ
£Ø1£©½«¹ĢĢå»ģŗĻĪļČÜÓŚĖ®£¬½Į°čŗóµĆµ½ĪŽÉ«ĶøĆ÷ČÜŅŗ£»
£Ø2£©Ķł“ĖČÜŅŗÖŠµĪ¼ÓĻõĖį±µČÜŅŗ£¬ÓŠ°×É«³ĮµķÉś³É£»
£Ø3£©ĶłÉś³É³ĮµķµÄŹŌ¹ÜÖŠ¼Ó×ćĮæĻ”ĻõĖį£¬³ĮµķČ«²æČܽā£¬²¢ÓŠĪŽÉ«ĘųĢå²śÉś£®
ŹŌÅŠ¶Ļ£ŗ¹ĢĢå»ģŗĻĪļÖŠæĻ¶ØÓŠ£ØĢī·Ö×ÓŹ½£© £¬æĻ¶Øƻӊ £®
µŚ£Ø2£©²½ŹµŃé·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ
µŚ£Ø3£©²½ŹµŃé·“Ó¦µÄĄė×Ó·½³ĢŹ½ŹĒ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠø÷×éĄė×ÓŌŚĖįŠŌČÜŅŗÖŠæÉŅŌ“óĮæ¹²“ęµÄŹĒ£Ø””””£©
”” A£® Ba2+ NO3© NH4+ B£® Na+ K+ SO32©
”” C£® Ca2+ CO32© Cl© D£® ClO© Na+ NH4+
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijČÜŅŗÖŠæÉÄÜŗ¬ÓŠ“óĮæĻĀĮŠŅõĄė×Ó£ŗOH©”¢SO42©”¢CO32©”¢Cl©£®
£Ø1£©µ±ČÜŅŗÖŠ“ęŌŚ“óĮæH+Ź±£¬ŌņČÜŅŗÖŠ²»æÉÄÜÓŠ“óĮæµÄ””””£®
µ±ČÜŅŗÖŠÓŠ“óĮæµÄBa2+“ęŌŚŹ±£¬ŌņČÜŅŗÖŠ²»æÉÄÜÓŠ“óĮæµÄ””””£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
»ÆѧÓėÉē»į”¢Éś»īĆÜĒŠĻą¹Ų£¬¶ŌĻĀĮŠĻÖĻó»ņŹĀŹµµÄ½āŹĶÕżČ·µÄŹĒ£Ø£©
Ń”Ļī ĻÖĻó»ņŹĀŹµ ½āŹĶ
A ÓĆČȵÄÉÕ¼īČÜŅŗĻ“Č„ÓĶĪŪ Na2CO3æÉÖ±½ÓÓėÓĶĪŪ·“Ó¦
B ĘÆ°×·ŪŌŚæÕĘųÖŠ¾ĆÖƱäÖŹ ĘÆ°×·ŪÖŠµÄCaCl2ÓėæÕĘųÖŠµÄCO2·“Ӧɜ³ÉCaCO3
C Ź©·ŹŹ±£¬²ŻÄ¾»Ņ£ØÓŠŠ§³É·ÖĪŖK2CO3£©²»ÄÜÓėNH4Cl»ģŗĻŹ¹ÓĆ K2CO3ÓėNH4Cl·“Ӧɜ³É°±Ęų»į½µµĶ·ŹŠ§
D FeCl3ČÜŅŗæÉÓĆÓŚĶÖŹÓ”Ė¢ĻßĀ·°åÖĘ×÷ FeCl3ÄÜ“Óŗ¬Cu2+µÄČÜŅŗÖŠÖĆ»»³öĶ
A£® A B£® B C£® C D£® D
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĪļÖŹµÄĮæÅضČĻąĶ¬µÄĻĀĮŠČÜŅŗ¢Ł£ØNH4£©2CO3 ¢Ś£ØNH4£©2SO4¢ŪNH4HCO3 ¢ÜNH4HSO4¢ŻNH4Cl ¢ŽNH3•H2O£»°“c£ØNH4+£©ÓÉŠ”µ½“óµÄÅÅĮŠĖ³ŠņÕżČ·µÄŹĒ£Ø£©
A£® ¢Ū¢Ż¢Ü¢Ž¢Ł¢Ū B£® ¢Ž¢Ż¢Ū¢Ü¢Ł¢Ś C£® ¢Ž¢Ū¢Ż¢Ü¢Ł¢Ś D£® ¢Ž¢Ū¢Ż¢Ü¢Ś¢Ł
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ČēĶ¼1ĖłŹ¾£¬Ä³Ķ¬Ń§Éč¼ĘĮĖŅ»øöČ¼ĮĻµē³Ų²¢Ģ½¾æĀČ¼ī¹¤ŅµŌĄķŗĶ“ÖĶµÄ¾«Į¶ŌĄķ£¬ĘäÖŠŅŅ×°ÖĆÖŠXĪŖŃōĄė×Ó½»»»Ä¤£®Ēė°“ŅŖĒó»Ų“šĻą¹ŲĪŹĢā£ŗ
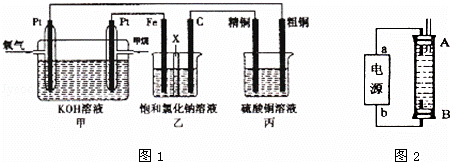
£Ø1£©¼×ĶéČ¼ĮĻµē³Ųøŗ¼«µē¼«·“Ó¦Ź½ŹĒ£ŗ £»
£Ø2£©ŹÆÄ«µē¼«£ØC£©µÄµē¼«·“Ó¦Ź½ĪŖ £»
£Ø3£©ČōŌŚ±ź×¼×“æöĻĀ£¬ÓŠ2.24LŃõĘų²Ī¼Ó·“Ó¦£¬ŌņŅŅ×°ÖĆÖŠĢśµē¼«ÉĻÉś³ÉµÄĘųĢåĢå»żĪŖ L£»±ū×°ÖĆÖŠŅõ¼«Īö³öĶµÄÖŹĮæĪŖ g£»
£Ø4£©Ä³Ķ¬Ń§Ąū¼×ĶéČ¼ĮĻµē³ŲÉč¼Ęµē½ā·ØÖĘČ”ĘÆ°×Ņŗ»ņFe£ØOH£©2µÄŹµŃé×°ÖĆ£ØČēĶ¼2ĖłŹ¾£©£®
ČōÓĆÓŚÖĘĘÆ°×ŅŗŹ±aĪŖµē³Ųøŗ¼«£¬µē½āÖŹČÜŅŗ×īŗĆÓĆ £®
ČōÓĆÓŚÖĘFe£ØOH£©2£¬Ź¹ÓĆĮņĖįÄĘ×öµē½āÖŹČÜŅŗ£¬Ńō¼«Ń”ÓĆĢś×÷µē¼«£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
Li”«SO2µē³Ų¾ßÓŠŹä³ö¹¦ĀŹøßĒŅµĶĪĀŠŌÄÜŗĆĢŲµć£¬Ęäµē½āÖŹĪŖLiBr£¬ČܼĮŹĒĢ¼Ėį±ūĻ©õ„ŗĶŅŅėę£¬Li+æÉŌŚĘäÖŠŅĘ¶Æ£®µē³Ų×Ü·“Ó¦Ź½ĪŖ£ŗ2Li+2SO2 Li2S2O4ĻĀĮŠÓŠ¹Ųµē³ŲµÄĖµ·ØÕżČ·µÄŹĒ£Ø£©
Li2S2O4ĻĀĮŠÓŠ¹Ųµē³ŲµÄĖµ·ØÕżČ·µÄŹĒ£Ø£©
A£® øƵē³Ų×Ü·“Ó¦ĪŖæÉÄę·“Ó¦
B£® ³äµēŹ±Ņõ¼«·“Ó¦Ź½ĪŖ£ŗLi++e﹣═Li
C£® ·ÅµēŹ±Li+Ļņøŗ¼«ŅʶÆ
D£® øƵē³Ųµē½āÖŹČÜŅŗæÉ»»³ÉLiBrĖ®ČÜŅŗ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com