
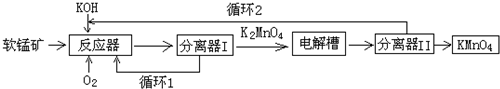
分析 (1)碱性条件下用氧气氧化MnO2得到K2MnO4,根据得失电子守恒和原子守恒写出相应的方程式;
(2)氧化铝是两性氧化物,氧化铝能和强碱反应生成偏铝酸盐和水,所以会导致KOH消耗量偏高.
(3)在电解槽中用铂板作用阳极,铁作阴极电解K2MnO4溶液得到KMnO4,阴极上水得电子发生还原反应生成氢气和氢氧根离子,阳极上锰酸根离子失电子反应氧化反应生成高锰酸根离子.
(4)根据题干信息可知反应物为K2MnO4、CO2、生成黑色固体MnO2、KMnO4,根据原子守恒书写化学反应方程式,根据方程式可知3molK2MnO4参加反应生成2molKMnO4、1molMnO2,据此判断氧化剂与还原剂的质量之比;电解法阳极都生成KMnO4,产率更高;
(5)发生反应:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根据方程式计算样品中草酸的质量,进而计算草酸的质量分数.
解答 解:(1)二氧化锰和氢氧化钾、氧气发生反应,生成锰酸钾和水,Mn(+4→+6),O(0→-2),反应的化学方程式为4KOH+2MnO2+O2=2K2MnO4+2H2O,
故答案为:4KOH+2MnO2+O2=2K2MnO4+2H2O;
(2)氧化铝是两性氧化物,既能与强酸反应也能与强碱反应,氧化铝和强碱反应生成偏铝酸盐和水,反应的化学方程式为2KOH+Al2O3=2KAlO2+H2O,所以会导致KOH消耗量偏高,
故答案为:偏高;
(3)电解锰酸钾溶液时,阴极上水得电子生成氢气和氢氧根离子,电极反应为2H2O+2e-=H2↑+2OH-,阳极上锰酸根离子失电子生成高锰酸根离子,电极反应式为2MnO42--2e-=2MnO4-,即MnO42--e-=MnO4-,则电极总反应为:2MnO42-+2H2O$\frac{\underline{\;电解\;}}{\;}$2MnO4-+2OH-+H2↑,
故答案为:2MnO42-+2H2O$\frac{\underline{\;电解\;}}{\;}$2MnO4-+2OH-+H2↑;
(4)反应物为K2MnO4、CO2、生成黑色固体MnO2、KMnO4,所以的化学方程式为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;
由化学反应方程式:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3分析得出,3molK2MnO4参加反应生成2molKMnO4、1molMnO2,即3mol高锰酸钾参与反应有1mol作氧化剂、2mol作还原剂,则反应中氧化剂与还原剂的质量比为1:2;
与该传统工艺相比,电解法阳极都生成KMnO4,产率更高,所以优势是产率更高、KOH循环利用;
故答案为:3K2MnO4+2CO2═2KMnO4+MnO2+2K2CO3;1:2;产率更高、KOH循环利用;
(5)在测定过程中,高锰酸钾为氧化剂,草酸为还原剂,反应的离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,根据方程式可得关系式:
5H2C2O4•2H2O~2KMnO4
5 2
n 0.02mol/L×14.8×10-3L×$\frac{100mL}{20mL}$
解得:n(H2C2O4•2H2O)=3.7×10-3mol
则m(H2C2O4•2H2O)=3.7×10-3mol×126g/mol=0.4662g,
所以成品的纯度为:$\frac{0.4662g}{0.500g}$×100%=93.2%,
故答案为:93.2%.
点评 本题考查实验制备方案的设计、物质分离与提纯方法的综合应用,题目难度中等,涉及化学实验基本操作、工艺流程、氧化还原反应滴定计算、物质含量的测定等知识,根据题中已知条件确定生成物并写出反应方程式明确原理是解题关键,是对学生综合能力的考查.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:解答题
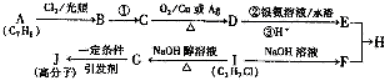
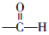 ,发生反应①的条件是氢氧化钠水溶液、加热.
,发生反应①的条件是氢氧化钠水溶液、加热. .
.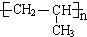 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氟 | 氯 | 溴 | 碘 | 铍 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 | 900 |
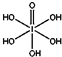 )和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸.请比较二者酸性强弱:H5IO6<HIO4(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
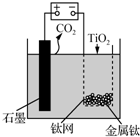 用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛.下列说法正确的是( )
用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制备金属钛.下列说法正确的是( )| A. | 电解过程中,Ca2+向阳极移动 | |
| B. | 阳极的电极反应式为:C+2O2--4e-═CO2↑ | |
| C. | 在制备金属钛前后,整套装置中CaO的总量减少 | |
| D. | 若用铅蓄电池作该装置的供电电源,“+”接线柱是Pb电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| B. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| C. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 | |
| D. | 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一旦将氨气用作燃料,将彻底解决能源危机 | |
| B. | 氨气燃烧的化学方程式可能为4NH3+5O2$\frac{\underline{\;点燃\;}}{\;}$4NO+6H2O | |
| C. | 比氢气更易储存,因为氨易液化 | |
| D. | 在氨燃料电池中,氨作正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1>V2=V3 | B. | V1>V2>V3 | C. | V1=V2=V3 | D. | V1=V2<V3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com