
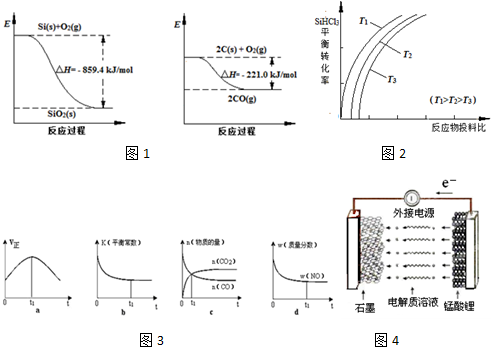
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
| 一定条件 |
| n(SiHCl3) |
| n(H2) |
| 催化剂 |
| 放电 |
| 充电 |
| n(H2) |
| n(SiHCl3) |
| n(H2) |
| n(SiHCl3) |
| 催化剂 |
| c2(CO2)c(N2) |
| c2(NO)c2(CO) |
| c2(CO2)c(N2) |
| c2(NO)c2(CO) |


科目:高中化学 来源: 题型:
| A、活化分子之间的碰撞不一定都是有效碰撞 |
| B、升高温度,可使单位体积内活化分子数增多,反应速率加快 |
| C、催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 |
| D、对于有气体参加的反应增大压强,可使单位体积内活化分子百分数增加,反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
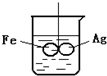 如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )| A、铁圈和银圈左右摇摆不定 |
| B、保持平衡状态 |
| C、铁圈向下倾斜,银圈向上倾斜 |
| D、银圈向下倾斜,铁圈向上倾斜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化铜和盐酸的反应:OH-+H+═H2O |
| B、氧化铜和盐酸的反应:Cu2++2H2O═2 H++Cu(OH)2↓ |
| C、铁与硫酸铜溶液的反应:Fe+Cu2+═Cu+Fe2+ |
| D、铁与稀硫酸的反应:Fe+2H+═Fe3++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ、某容积不变的密闭容器中充入等物质的量的气体A和B,某温度下发生反应:
Ⅰ、某容积不变的密闭容器中充入等物质的量的气体A和B,某温度下发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
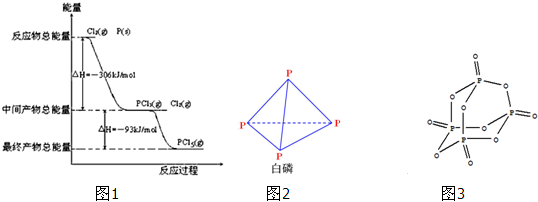
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ?mol-1) | 198 | 360 | 498 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固体电解质中O2-向正极移动,向外电路释放电子的电极是负极 |
| B、这个电池负极发生的反应是:C4H10+13O2--26e-═4CO2+5H2O |
| C、这种电池放电时发生的化学反应方程式为:2C4H10+13O2═8CO2+10H2O |
| D、人们追求燃料电池氧化汽油,而不在内燃机里燃烧汽油产生动力的主要原因是燃料电池具有较高的能量利用率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com