
.下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.高温下,工业上用纯碱和石英砂制玻璃,说明硅酸的酸性强于碳酸
C.加热蒸干氯化铝溶液并灼烧残留物至质量不变,所得固体为氧化铝
D.高温下,用金属钠与氯化钾可以置换出金属钾,说明钠的金属性比钾强
【知识点】物质的性质及化学规律的解释G2 D1 C1
【答案解析】AC 解析:A、反应NH3(g)+HCl(g)=NH4Cl(s)是熵减的反应,在室温下可自发进行,一定是放热反应,△H<0,故A正确;B、因为反应在高温下进行,不能说明硅酸的酸性强于碳酸,根据反应Na2SiO3+H2O+CO2=Na2CO3+H2SiO3常温下进行,判断碳酸的酸性强于硅酸,故B错误;C、AlCl3+3H2O Al(OH)3+3HCl,HCl挥发,水解平衡右移,得氢氧化铝,灼烧残留物至质量不变,所得固体为氧化铝,故C正确;D、高温下,用金属钠与氯化钾可以置换出金属钾,是因为钾的沸点比钠的低,不能说明钠的金属性比钾强,故D错误。
Al(OH)3+3HCl,HCl挥发,水解平衡右移,得氢氧化铝,灼烧残留物至质量不变,所得固体为氧化铝,故C正确;D、高温下,用金属钠与氯化钾可以置换出金属钾,是因为钾的沸点比钠的低,不能说明钠的金属性比钾强,故D错误。
故答案选AC
【思路点拨】本题考查了物质的性质及化学规律的解释,注意钾的金属性比钠强,但是用金属钠与氯化钾可以置换出金属钾,学习中多思考出现反常的原因。


科目:高中化学 来源: 题型:
偏二甲肼与N2O4 是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2 (l )+2N2O4 (l )=2CO2 (g )+3N2 (g )+4H2O (l ) (Ⅰ)
(1)若将反应(Ⅰ)设计成原电池,则正极的电极反应式为
(酸性电解质)。
(2)火箭残骸中常现红棕色气体,原因为:N2O4 (g) 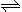 2NO2 (g) (Ⅱ)
2NO2 (g) (Ⅱ)
当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4 充入一恒压密闭容器中,
下列示意图正确且能说明反应达到平衡状态的是________.
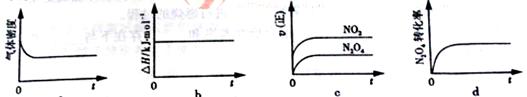
若在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数________(填“增大”“不变”或“减小”),反应3s后NO2的物质的量为0.6mol,则0~3s内的平均反应速率v(N2O4)=________mol·L-1·s-1。
(4)NO2可用氨水吸收生成NH4NO3 。25℃时,将amol NH4NO3溶于水,溶液显酸性,原因是 (用离子方程式表示)。向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中的水的电离平衡将______(填“正向”“不”或
“逆向”)移动,所滴加氨水的浓度为_______mol·L-1。(NH3·H2O的电离平衡常数
Kb=2×10—5 mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
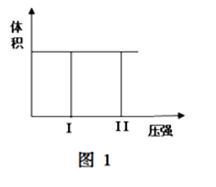
( I) 在一个容积固定不变的密闭容器中进行反应:
2X(g) + Y(g)  2Z(g) 若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。
2Z(g) 若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H 0; ( 填:“< ,> ,= ”)。该反应在 (填:高温或低温)条件下能自发进行。
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,
pC(g) ,
在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如
下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
⑴当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
⑵维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol.
⑶当压强为1×106 Pa时,此反应的平衡常数表达式: 。
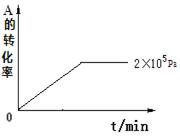
⑷其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如下图,请在图中补充画出压强分别为5×105 Pa和1×106 Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。
查看答案和解析>>
科目:高中化学 来源: 题型:
.下列事实不能用平衡移动原理解释的是
|
|
|
| |||||||||||||
| A | B | C | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生设计一水果电池:他把一铁钉和碳棒用导线连接好,然后将铁钉和碳棒平行插入一新鲜西红柿中,再在导线中接一个灵敏电流计.据此下列叙述正确的是 ( )
A.电流计指针不会发生偏转
B.金属铁会被腐蚀
C.碳棒作负极
D.铁表面有气体逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上利用氢气在氯气中燃烧,所得产物再溶于水的方法制盐酸,流程复杂且造成能量浪费.有人设想利用原电池原理直接制备盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是 ( )
A.两极材料都用石墨,用稀盐酸作电解质溶液
B.通入氢气的电极为原电池的正极
C.电解质溶液中的阳离子向通氯气的电极移动
D.通氯气的电极的反应式为Cl2+2e-===2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是 ( )
A.该溶液的pH=4
B.升高温度,溶液的pH增大
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中能大量共存的是( )
①pH=11的溶液中:CO32﹣、Na+、AlO2﹣、NO3﹣
②无色溶液中:K+、Na+、MnO4﹣、SO42﹣
③加入Al能放出H2的溶液中:Cl﹣、HCO3﹣、SO42﹣、NH4+
④含有Fe2+的溶液中:[Fe(CN)6]3﹣、NO3﹣、Cl﹣
⑤由水电离出的c(OH﹣)=1×10﹣13mol•L﹣1的溶液中:Na+、Ba2+、Cl﹣、Br﹣.
|
| A. | ①⑤ | B. | ②③ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com