
【题目】I.无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图所示(夹持装置省略)。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5。
MgBr2·3C2H5OC2H5。

主要步骤如下:
步骤1:三颈烧瓶中装入10g镁屑和150mL无水乙醚;装置C中加入15mL液溴;
步骤2:缓慢通入干燥的氩气,直至溴完全导入三颈烧瓶中;
步骤3:反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品;
步骤4:常温下用CCl4溶解粗品,冷却至0℃,析岀晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
请回答下列问题
(1)仪器A的名称是___________。B的作用为___________。
(2)下列有关步骤4的说法正确的是___________(填选项字母)
A.可用75%的乙醇代替CCl4溶解粗品
B.加热至160℃的主要目的是除去CCl4
C.洗涤晶体可选用0℃的CCl4
D.该步骤只除去了可能残留的溴
(3)若将装置C改为装置D,可能会导致的后果是___________。
(4)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,以铬黑T(简写为In)为指示剂。已知Mg2+与铬黑T和EDTA均能形成配合物,且EDTA与Mg2+配合更稳定:
物质 | 颜色 | 物质 | 颜色 |
Y4- | 无色 | MgY2- | 无色 |
In | 纯蓝色 | MgIn- | 酒红色 |
反应的离子方程式为Mg2++Y4-=MgY2-
①滴定终点的现象为______________________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加入2滴铬黑T试液作指示剂,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00mL,则测得无水MgBr2产品的纯度是______________________(用质量分数表示)。
Ⅱ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:2Mg5Al3(OH)19(H2O)4===27H2O+10MgO+3Al2O3。
(5)写出该化合物作阻燃剂的两条依据:______________________。
(6)MgO可溶于NH4Cl的水溶液,用离子方程式表示其原理:______________________。
【答案】干燥管 冷凝回流溴和乙醚 C 会将液溴快速压入三颈烧瓶,反应过快大量放热而存在安全隐患 滴入最后一滴EDTA标准液时,溶液由酒红色变为纯蓝色,且半分钟内保持不变 92% 分解反应是吸热反应,使环境温度降低;生成的氧化镁、氧化铝附着表面隔绝空气;水蒸气稀释空气 ![]()
【解析】
(1)根据装置图分析仪器A的名称。根据溴、乙醚易挥发分析冷凝管B的作用;(2)步骤4的目的是提纯三乙醚合溴化镁,根据三乙醚合溴化镁的性质分析;(3)若将装置C改为装置D,会将液溴快速压入三颈烧瓶;(4) ① 滴定终点时MgIn-完全转化为In;②根据Mg2++Y4-=MgY2-计算MgBr2产品的纯度;(5) 分解反应吸热;氧化镁、氧化铝附着表面隔绝空气;(6)MgO与NH4Cl溶液反应生成氯化镁、氨水。
(1)根据装置图,仪器A的名称是干燥管。溴、乙醚易挥发,所以冷凝管B的作用是冷凝回流溴和乙醚,提高原料利用率;(2) A. MgBr2具有强吸水性,不能用75%的乙醇代替CCl4溶解粗品,故A错误; B.加热至160℃的主要目的是分解三乙醚合溴化镁,故B错误; C.乙醚和溴能溶于CCl4, 0℃的CCl4降低三乙醚合溴化镁的溶解度,故C正确; D.该步骤除去了可能残留的溴和乙醚,故D错误;选C。(3)若将装置C改为装置D,会将液溴快速压入三颈烧瓶,Mg和Br2反应剧烈放热,反应过快大量放热而存在安全隐患;(4)滴定终点时MgIn-完全转化为In,滴定终点的现象为滴入最后一滴EDTA标准液时,溶液由酒红色变为纯蓝色,且半分钟内保持不变;
②设样品中MgBr2的物质的量为xmol
Mg2++Y4-=MgY2-
1 1
X 0.05mol·L-1![]() 0.025L
0.025L
X=0.00125mol
MgBr2产品的纯度是![]()
(5) 2Mg5Al3(OH)19(H2O)4===27H2O+10MgO+3Al2O3,反应是吸热反应,使环境温度降低;生成的氧化镁、氧化铝附着表面隔绝空气;水蒸气稀释空气,所以Mg5Al3(OH)19(H2O)4作阻燃剂;(6)MgO与NH4Cl溶液反应生成氯化镁、氨水,反应离子方程式是![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】欲配制0.1mol/L的NaHCO3溶液250mL,完成下列步骤:
(1)用电子天平称取NaHCO3固体______________g;
(2)将称好的NaHCO3固体放入______________,加适量的蒸馏水将其___________;
(3)待溶液_____________后,将溶液沿着______________移入250mL容量瓶中,在操作过程中不能损失任何一点液体,否则会使溶液的浓度偏_________(高或低);
(4)用少量蒸馏水冲洗_______________2-3次,将洗涤液移入______________中;
(5)向容量瓶内加水至距离刻度线______________时,改用________________小心加水至___________________,若加水超过刻度线,会造成溶液浓度偏_________(高或低),应该_____________;
(6)最后盖好瓶盖,___________,然后将配好的溶液移入试剂瓶中,贴好标签。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将燃料电池与电解池组合制备KMnO4的装置如图所示(电极甲、乙、丙、丁均为惰性电极)。该装置工作时,下列说法不正确的是

A. 甲为正极,丙为阴极
B. 丁极的电极反应式为MnO42――e-===MnO4-
C. KOH溶液的质量分数:c%>a%>b%
D. 标准状况下,甲电极上每消耗22.4L气体时,理论上有4molK+移入阴极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验研究”的探究活动。
(1)本课题的研究对象是CH3COOH,研究目的是_____,研究方法是实验研究。
(2)该同学设计了如下方案:
A.先配制一定量的0.10mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质。
B.先配制0.01mol/L和0.10mol/L的CH3COOH,分别测他们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质。
C.先测0.10mol/LCH3COOH的pH,然后将其加热至100℃(不考虑醋酸挥发),再测pH,如果pH变小,则可证明醋酸是弱电解质。
D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质。
你认为上述方案可行的是____(多项选择)
(3)请回答以下两个问题:
①弱电解质的特点是____(多项选择)
A.在水溶液中全部电离 B.在水溶液中部分电离
C.水溶液呈酸性 D.水溶液中存在电离平衡
②写出醋酸的电离方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下向20mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化)。下列说法中正确的是( )
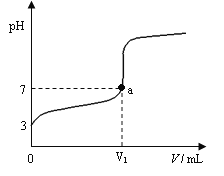
A. 该温度下醋酸的电离平衡常数约为1×10-5mol·L-1
B. 图中V1>20mL,且a点对应的溶液中:c (Na+)+ c (H+) = c (OH-)+ c (CH3COO-)
C. 图中V1<20mL,且a点对应的溶液中:c (CH3COOH) + c (CH3COO-) <c (Na+)
D. 当加入NaOH溶液的体积为20mL时,溶液中:c (CH3COOH) + c (H+) > c (OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用纯净的CaCO3与100 mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积),下列分析正确的是( )

A.OE段表示的平均速率最快
B.EF段,用盐酸表示该反应的平均反应速率为0.4 mol·L-1·min-1
C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2∶6∶7
D.F点收集到的CO2的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石墨烯是目前科技研究的热点,可看作将石墨的层状结构一层一层的剥开得到的单层碳原子。将氢气加入到石墨烯排列的六角晶格中可得最薄的导电材料石墨烷(如下图),下列说法中正确的是

A. 石墨烯与石墨烷互为同系物
B. 石墨烯转变为石墨烷可看作取代反应
C. 石墨烯在氧气中完全燃烧,只产生二氧化碳气体。
D. 石墨烷的化学式通式是CnH2n+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 10g46%甲酸(HCOOH)水溶液所含的氧原子数为0.5NA
B. 1molCnH2n+2所含的共用电子对数为(2n+1)NA
C. 含有C﹣Si数目为2NA的SiC晶体中硅原子的物质的量为1mol
D. 常温下,5.6gFe与含0.2molHNO3的溶液充分作用,最少会失去电子数为0.15NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com