
可逆反应2HI(g) I2(g)+H2(g)在密闭容器中进行,当下列中的四项中的某项不随时间变化时,不能说明反应达到平衡的是( )
I2(g)+H2(g)在密闭容器中进行,当下列中的四项中的某项不随时间变化时,不能说明反应达到平衡的是( )
A.各组分的物质的量 B.混合物的温度 C.容器内压强 D.混合气体的颜色
科目:高中化学 来源: 题型:
通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下列是一些化学键的键能。
| 化学键 | C—H | C—F | H—F | F—F |
| 键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
根据键能数据估算下列反应CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH为]
A.-1940kJ·mol-1 B.1940kJ·mol-1 C.-485kJ·mol-1 D.485kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知有钠、钾及钠钾合金,对于它们三者熔点高低比较正确的是( )
A.钠钾合金>钠>钾 B.钠>钾>钠钾合金
C.钠>钠钾合金>钾 D.钾>钠钾合金>钠
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数,下列叙述正确的是
A.标准状况下,11.2L的O2和NO的混合物含有的分子数约为0.5×6.02×1023
B.1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA
C.常温常压下42g 乙烯和丁烯混合气体中,极性键数为6NA
D.6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
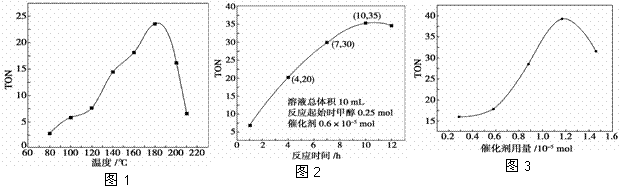
碳酸二甲酯(DMC)是一种近年来受到广泛关注的环保型绿色化工产品。在催化剂作用下,可由甲醇和CO2直接合成DMC:CO2+2CH3OH―→CO(OCH3)2+H2O,但甲醇转化率通常不会超过1%是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。
计算公式为TON=转化的甲醇的物质的量/催化剂的物质的量。
 (1)已知25 ℃时,甲醇和DMC的标准燃烧热分别为ΔH1和ΔH2,则上述反应在25 ℃时的焓变ΔH3=________。
(1)已知25 ℃时,甲醇和DMC的标准燃烧热分别为ΔH1和ΔH2,则上述反应在25 ℃时的焓变ΔH3=________。
(2)根据反应温度对TON的影响图(图1)判断该反应的焓变ΔH________0(填“>”、“=”或“<”),理由是_________________。
(3)根据反应时间对TON的影响图(图2),已知溶液总体积 10 mL,反应起始时甲醇0.25 mol,催化剂0.6×10-5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________;计算10 h时,甲醇的转化率:________。
(4)根据该研究小组的实验及催化剂用量TON的影响图(图3),判断下列说法正确的是________。
a.由甲醇和CO2直接合成DMC,可以利用价廉易得的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面都具有重要意义
b.在反应体系中添加合适的脱水剂,将提高该反应的TON
c.当催化剂用量低于1.2×10-5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
d.当催化剂用量高于1.2×10-5 mol时,随着催化剂用量的增加,DMC的产率反而急剧下降
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法,你认为不正确的是( )。
A.平衡常数随温度的改变而改变
B.对于密闭容器中反应2SO2+O2 2SO3,2体积SO2与足量O2反应,能生成2体积SO
2SO3,2体积SO2与足量O2反应,能生成2体积SO 3
3
C.合成氨反应中使用催化剂,降低了反应所需要的活化能。
D.反应H2(g)+I2 (g)
(g)  2HI(g) 在450℃时,其平衡常数为49;则反应
2HI(g) 在450℃时,其平衡常数为49;则反应
HI(g)  1 ∕ 2 H2(g) +1 ∕ 2 I2(g) 在450℃时的平衡常数为1 ∕ 7
1 ∕ 2 H2(g) +1 ∕ 2 I2(g) 在450℃时的平衡常数为1 ∕ 7
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:
2Fe+2H2O+O2 = 2Fe2++4OH-。以下说法正确的是 ( )
A.负极发生的反应为:Fe-2e- = Fe2+
B.正极发生的反应为:2H2O+O2+2e- = 4OH-
C.原电池是将电能转变为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中c(Cl-)与50 mL 1 mol/LAlCl3溶液中c(Cl-)相等的是
A.150 mL 1 mol/L的NaCl溶液 B.75 mL 2 mol/L的NH4Cl溶液
C.150 mL 2 mol/L的KCl溶液 D.75 mL 1 mol/L的FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车尾气里含有NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:
N2(g) + O2(g) 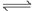 2NO(g) △H > 0
2NO(g) △H > 0
已知该反应在2404℃时,平衡常数K=64×10-4。请回答:
(1)该反应的平衡常数表达式为 。
(2)该温度下,向2L密闭容器中充入N2和O2各1mol,平衡时,N2的转化率是 %(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,此时反应 (填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是
。
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是
(填字母序号)。
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数 (填“变大、“变小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com