
| A. | 水溶性:乙醇>新戊烷>苯酚 | |
| B. | 同质量的物质燃烧消耗O2量:乙烷>甲烷>乙炔 | |
| C. | 密度:水>苯>硝基苯 | |
| D. | 沸点:正戊烷>异戊烷>新戊烷 |
分析 A.亲含有氢键的水溶性好;
B.若烃为CxHy,同质量的物质燃烧耗O2量为$\frac{m}{M}$×(x+$\frac{y}{4}$);
C.苯密度小于水,而硝基苯密度大于水;
D.烷烃的同分异构体中,含有支链越多其熔沸点越低.
解答 解:A.含有氢键的水溶性好,所以水溶性:乙醇>苯酚>新戊烷,故A错误;
B.若烃为CxHy,同质量的物质燃烧耗O2量为$\frac{m}{M}$×(x+$\frac{y}{4}$),显然甲烷消耗氧气最多,大小顺序为甲烷>乙烷>乙炔,故B错误;
C.苯密度小于水,而硝基苯密度大于水,所以密度:硝基苯>水>苯,故C错误;
D.烷烃的同分异构体中,含有支链越多其熔沸点越低,所以熔沸点:正戊烷>异戊烷>新戊烷,故D正确;
故选D.
点评 本题考查学生利用燃烧通式的计算及物理性质的比较,注意规律的应用是解答本题的关键,易错点是B中耗氧量的计算,注意有机物是质量相同还是物质的量相同,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 将混有HCl的Cl2通入盛有饱和NaHCO3溶液的洗气瓶除去 | |
| B. | 实验室制取Cl2,浓盐酸起到酸性和还原剂的作用 | |
| C. | 用惰性电极电解饱和食盐水的离子方程式为2Cl-+2H+$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| D. | 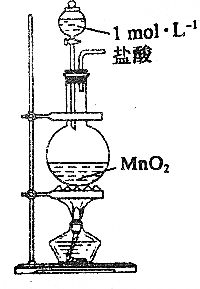 实验室可用图所示装置于制取少量Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的电子式: | |
| B. | HClO的结构式为:H-Cl-O | |
| C. | 氯化镁的电子式: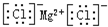 | |
| D. | 用电子式表示氯化氢分子的形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2+O2═2H2O△H=-571.6 kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g )△H=-285.8kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用新制Cu(0H)2悬浊液不能鉴别麦芽糖和蔗糖 | |
| B. | 硫酸铵和醋酸铅溶液均可使鸡蛋清溶液中的蛋白质变性 | |
| C. | 油是不饱和高级脂肪酸的简单甘油酯,是纯净物 | |
| D. | 用银镜反应可证明蔗糖是否转化为葡萄糖,但不能证明是否完全转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
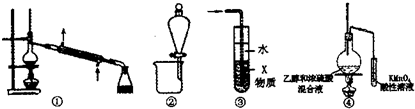
| A. | 装置①可用于石油的分馏 | |
| B. | 装置②可用于苯提取溴水中的Br2 | |
| C. | 装置③中X若为四氯化碳,可用于吸收氨气或氯化氣,并防止倒吸 | |
| D. | 装置④验证乙烯的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸水浴加热并保持55~60℃反应生成硝基苯 | |
| B. | 乙醇在浓硫酸作催化剂和脱水剂且加热至170℃时发生消去反应生成乙烯 | |
| C. | 溴乙烷在氢氧化钠醇溶液中加热发生消去反应生成乙烯 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4二氯甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2[CuSO4] | B. | NaCl[HCl] | C. | NaOH[Na2O] | D. | CuSO4[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
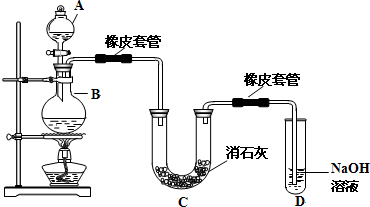
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com