
【题目】已知:①2FeCl3+2KI===2FeCl2+2KCl+I2;②2FeCl2+Cl2=2FeCl3。下列粒子的氧化性从强到弱的顺序正确的是
A. Cl2>Fe3+>I2 B. I2>Cl2>Fe3+ C. Fe3+>Cl2>I2 D. Cl2>I2>Fe3+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】CH3OH是一种重要的化工原料,工业上可用合成气(CO和H2)来生产,主要副产物有CH4、C2H5OH等。已知生产CH3OH和副产物CH4的热化学方程式分别为
①CO(g)+2H2(g)![]() CH3OH(g) △H=-90.7 kJ·mol-1
CH3OH(g) △H=-90.7 kJ·mol-1
②CO(g)+ 3H2(g)![]() CH4(g)+H2O(g) △H=-206.2 kJ·mol-1
CH4(g)+H2O(g) △H=-206.2 kJ·mol-1
回答下面问题
(1)若CO(g)和CH3OH(g)的燃烧热△H分别为-283 kJ·mol-1和-726.1 kJ·mol-1,则H2(g)的燃烧热△H为 。
(2)下表列出了几种化学键断裂需要的能量数据。
化学键 | C≡O | H-H | C-H | H-O |
断裂1mol需要能量 / kJ | a | 436 | 414 | 463 |
则a= 。
(3)工业生产CH3OH过程中,提高合成CH3OH反应选择性的关键因素是 。
(4)下表列出了在一定条件下,在3个1L容器中发生反应①时测得的一些数据。
容器序号 | 温度 / ℃ | 物质的起始浓度 / mol·L-1 | 物质平衡时浓度/ mol·L-1 | ||
H2 | CO | CH3OH | CH3OH | ||
Ⅰ | 100 | 0.2 | 0.1 | 0 | 0.02 |
Ⅱ | 100 | 0.4 | 0.2 | 0.1 | |
Ⅲ | 200 | 0 | 0 | 0.10 | b |
① CO(g)+2H2(g)![]() CH3OH(g)的平衡常数表达式为 ;
CH3OH(g)的平衡常数表达式为 ;
② 容器Ⅱ中,开始时,v(正) v(逆) (填“<、>、=”) ;
③ 容器Ⅲ中,达平衡时 b 0.02(填“<、>、=”) ;
④ 达到平衡时,正反应速率:容器Ⅲ中的比容器Ⅰ中的 (填“大、小、相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为:
Cd+2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
A.充电过程是化学能转化为电能的过程
B.充电时阳极反应为Cd(OH)2+2e—== Cd + 2OH -
C.放电时电池内部OH - 向正极移动
D.充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤.正确的操作顺序是( )
A.②③①④⑤
B.①②③⑤④
C.③②①⑤④
D.③⑤②①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中,产生NO的反应为:N2(g)+O2(g) ![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是( )
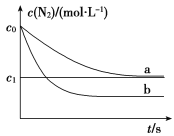
A.温度T下,该反应的平衡常数K=![]()
B.温度T下,随着反应的进行,混合气体的密度减小
C.曲线b对应的条件改变可能是加入了催化剂
D.若曲线b对应的条件改变是温度,可判断该反应的ΔH <0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:
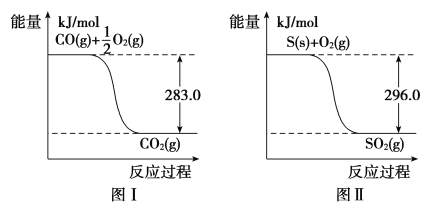
则:(1)① 不用通入O2氧化的方法除去CO的原因是____________________。
②SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
CO2(g)+H2(g),已知420 ℃时,该反应的化学平衡常数K=9。如果反应开始时,在2 L的密闭容器中充入CO和H2O的物质的量都是0.60 mol,5 min末达到平衡,则此时CO的转化率为________,H2的平均生成速率为________ mol·L-1·min-1。
(3)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示:
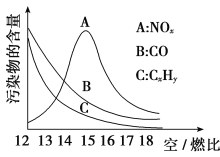
①随空/燃比增大,CO和CxHy的含量减少的原因是_______________________。
②当空/燃比达到15后,NOx减少的原因可能是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素是参与生物生长发育和新陈代谢所必须的物质,中学生每天需要补充一定量的维生素C。下列食品中维生素C含量最丰富的是
A.植物油 B.馒头 C.牛肉 D.橙子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,在向滤液中加入适量的盐酸,这种试剂是
A. NH3·H2O B. NaOH C. Na2CO3 D. MgCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com