
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.23g Na 与足量H2O反应完全后可生成NA个H2分子
B.1 molCu和足量热浓硫酸反应可生成NA个SO3分子
C.标准状况下,22.4LN2和H2混合气中含NA个原子
D.3mol单质Fe完全转变为Fe3O4,失去8NA个电子
科目:高中化学 来源:2017届江西省高三上第一次月考化学试卷(解析版) 题型:选择题
SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
则下列有关说法不正确的是
A.氧化性:Cr2O72->Fe3+>SO2
B.标准状况下,若有6.72 L SO2参加反应,则最终消耗0.2 mol K2Cr2O7
C.反应②中,每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA
D.由上述反应原理推断:K2Cr2O7能将Na2SO3氧化成Na2SO4
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上第一次月考化学试卷(解析版) 题型:填空题
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是__________________。
(2)已知0.2 mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)根据上述反应可推知__________________。
A.氧化性:KBrO3>H3AsO4 B.氧化性:H3AsO4>KBrO3
C.还原性:AsH3>X D.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目:(注:请一定用单线桥表示,凡是用双线桥表示的不得分)


(5)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。写出该反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上第一次月考化学试卷(解析版) 题型:选择题
亚氨基锂(Li2NH)是一种储氢容量高,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。下列有关说法正确的是( )
A.Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等 D.此法储氢和钢瓶储氢的原理相同
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上第一次月考化学试卷(解析版) 题型:选择题
水溶液中能大量共存的一组离子是( )
A.Na+、Al3+、Cl-、CO32-
B.H+、Na+、Fe2+、MnO4-
C.K+、Ca2+、Cl-、NO3-
D.K+、NH4+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上9月综合能力测试化学试卷(解析版) 题型:填空题
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2 CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
实验序号 | 温度℃ | 初始CCl4浓度(mol·L﹣1) | 初始H2浓度(mol·L﹣1) | CCl4的转化率 |
1 | 110 | 1 | 1 | 50% |
2 | 100 | 1 | 1 | x |
3 | 110 | 0.8 | y | 60% |
(1)实验1中,10h后反应达到平衡,则从反应开始至达到平衡状态,H2的平均反应速率为 mol·L﹣1·h﹣1.在此实验的平衡体系中,再加入0.5mol CCl4和0.5mol HCl,平衡将怎样移动? (填“向左移动”、“向右移动”、“不移动”或“无法确定”).
(2)实验2中,x为 (填字母).
A.等于50% B.大于50% C.小于50% D.无法确定
(3)实验3中的y为 .
(4)在100℃条件下,能说明反应CCl4+H2 CHCl3+HCl△H<O达到平衡状态的是 (填字母).
CHCl3+HCl△H<O达到平衡状态的是 (填字母).
A.压强不再变化 B.生成HCl的速率和消耗H2的速率相等
C.混合气体的密度不变 D.H2的质量不再变化
(5)用电解法处理高浓度重铬酸钠废水具有效果稳定可靠,操作管理简单,设备占地面积小,废水中的重金属离子也能通过电解有所降低等优点,其原理是铁作电极,在酸性条件下,将Cr6+还原为Cr3+,其装置示意图如图所示.
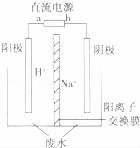
若以甲醚燃料电池为直流电源(电解质溶液为KOH溶液),则燃料电池中b极应通入 ,a极的电极反应为 .
能否用铜作电解重铬酸钠废水的电极? (填“能”或“不能”),理由是
③除去重铬酸根离子的离子反应是 .
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上9月综合能力测试化学试卷(解析版) 题型:选择题
混合气体由N2和CH4组成,测得混合气体在标准状况下的密度为0.821g/L,则混合气体中N2和CH4的体积之比为( )
A、1:1 B、1:4 C、4:1 D、1:2
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期9月月考化学试卷(解析版) 题型:选择题
等体积的硫酸铝、硫酸锌、硫酸钠溶液分别与足量氯化钡溶液反应。若生成硫酸钡沉淀的质量比为1:3:2,则三种硫酸盐的物质的量浓度之比为( )
A.1:2:3 B.1:4:9 C.1:9:6 D.1:6:3
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三暑假阶段性考试化学试卷(解析版) 题型:选择题
如图所示,①和②为两个体积相同的固定容器,图中“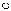 ”和“
”和“ ”分别表示氢原子和氧原子,则下列说法正确的是( )
”分别表示氢原子和氧原子,则下列说法正确的是( )
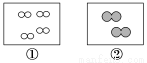
A.若①中的H2为1 mol,则②中所含原子总数为3.01×1023个
B.①和②中气体的质量之比为1∶8
C.H2、O2均能发生化合反应,但不能发生置换反应
D.两容器的温度和压强均相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com