
| A. | Y单质不能与X的氢化物反应 | |
| B. | Y的氢化物是离子化合物 | |
| C. | 工业上冶炼Z通常用电解其熔融氯化物的方法 | |
| D. | W单质既能与酸反应,又能与碱反应,属于两性物质 |
分析 X、Y、Z、W为原子序数依次增大的短周期主族元素,X原子最外层有6个电子,结合原子序数可知,X为O元素;Y是其所处周期中金属性最强的元素,原子序数大于氧,则Y为Na;Z在周期表中处于周期序数等于族序数的位置,Y是至今发现的非金属性最强的元素,则Y为F元素;Z、W处于第三周期,Z在周期表中处于周期序数等于族序数的位置,则Z为Al,W与Z的最外层电子数之和为10,W原子最外层电子数为10-3=7,故W为Cl,据此解答.
解答 解:X、Y、Z、W为原子序数依次增大的短周期主族元素,X原子最外层有6个电子,结合原子序数可知,X为O元素;Y是其所处周期中金属性最强的元素,原子序数大于氧,则Y为Na;Z在周期表中处于周期序数等于族序数的位置,Y是至今发现的非金属性最强的元素,则Y为F元素;Z、W处于第三周期,Z在周期表中处于周期序数等于族序数的位置,则Z为Al,W与Z的最外层电子数之和为10,W原子最外层电子数为10-3=7,故W为Cl.
A.Na能与水反应生成氢氧化钠与氢气,故A错误;
B.Y的氢化物为NaH,属于离子化合物,故B正确;
C.氯化铝属于共价化合物,熔融状态下不导电,工业上电解熔融氧化铝冶炼Al,故C错误;
D.氯气具有强氧化性,能与还原性反应,能与碱反应,但不属于两性物质,故D错误,
故选:B.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意掌握元素化合物性质,难度中等.


科目:高中化学 来源: 题型:解答题
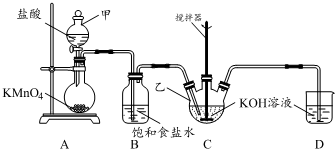 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
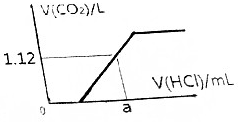 取Na2CO3和NaHCO3的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g.
取Na2CO3和NaHCO3的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的结构简式:-CHO | B. | 甲烷的电子式: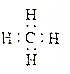 | ||
| C. | 乙炔分子的结构式:H-C≡C-H | D. | 乙醇的分子式:C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | 物质的量浓度相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中,c(NH4+)大小顺序为:③>②>① | |
| C. | 等体积,等物质的量浓度的Na2S溶液与NaHS溶液混合后:3c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | |
| D. | 等体积、等物质的量浓度的Na2SO3溶液与HCl溶液混合后:c(H+)+c(H2SO3)═c(SO32-)++c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
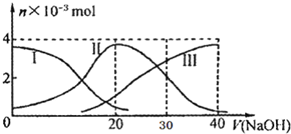 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-),根据图示判断,下列说法不正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-),根据图示判断,下列说法不正确的是( )| A. | H2A在水中的电离方程式是:H2A═H++HA-;HA-═H++A2- | |
| B. | 当V(NaOH)=20mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小 | |
| D. | 当V(NaOH)=30mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2 c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com