
分析 (1)制备氢氧化铁胶体的方法:向25ml沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热;
(2)只有胶体具有丁达尔效应,可以验证胶体的产生;
(3)水溶液中或熔融状态下导电的化合物为电解质,胶体为混合物;
(4)①胶体的电泳实验证明了胶体胶粒是带电的;
②向胶体中加入可溶性的盐、加热、搅拌等条件会使胶体聚沉;
③胶体中加入稀硫酸会发生聚沉,氢氧化铁生成红褐色沉淀,继续加入氢氧化铁会溶解得到硫酸铁溶液;
④半透膜能允许离子和分子透过,胶体不能透过;
解答 解:(1)甲同学向1mol•L-氯化铁溶液中加入少量的NaOH溶液,会发生复分解反应生成红褐色沉淀,乙同学直接加热饱和FeCl3溶液,三价铁会水解生成红褐色沉淀,制备氢氧化铁胶体的方法:向25ml沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,原理是:FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3(胶体)+3HCl,
故答案为:丙;FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
(2)胶体具有丁达尔效应:当光束通过胶体时,从侧面观察到一条光亮的“通路”,
故答案为:用激光笔照射,有一条明亮的光路,则有胶体生成;
(3)Fe(OH)3胶体是防止和分散剂组成的分散系,为混合物,不是电解质,故答案为:不是;
(4)①胶体具有电泳性质,电泳实验证明了胶体胶粒带点,胶粒向负极移动,说明Fe(OH)3胶粒带正电,故答案为:正;
②胶体具有聚沉的性质,向胶体中加入可溶性的盐、加热、搅拌等条件会使胶体聚沉,向其中加入饱和Na2SO4溶液,产生的现象是聚沉得到黄色沉淀,
故答案为:生成红褐色的沉淀;
③向氢氧化铁胶体中逐滴加入过量H2SO4溶液,H2SO4电离出的SO42-使Fe(OH)3胶体发生聚沉,H+使Fe(OH)3沉淀溶解,会观察到先出现红褐色沉淀,后沉淀消失.
是发生了反应 2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O,
故答案为:加电解质胶体聚沉; 2Fe(OH)3+3H2SO4=Fe2(SO4)3+6H2O;
④Na+、Cl-均可以通过半透膜,Fe(OH)3胶体不能透过,故可以采用渗析法来提纯胶体,所用仪器物品是半透膜,提纯分离的方法为渗析,
故答案为:半透膜;渗析;
点评 本题考查胶体的制备、性质,题目难度不大,易错点为胶体的制备,注意制备方法,本题重点把握胶体的聚沉的性质.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:选择题
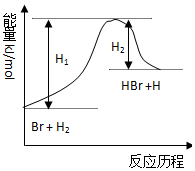
| A. | 正反应为放热反应 | |
| B. | 加入催化剂,该化学反应的反应热不改变 | |
| C. | 逆反应为吸热反应 | |
| D. | 加入催化剂可增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+Mg2+ CO32-Cl- | B. | Fe3+Cl- Na+H+ | ||
| C. | H+ Ag+ NO3- NH4+ | D. | CO32-H+Na+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO3溶液和NaHCO3溶液反应:H2SO3+2HCO3-=SO32-+2CO2↑+2H2O | |
| B. | 控制pH为9~10,用NaClO溶液将含NaCN的废水中的CN-氧化为两种无污染的气体:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O | |
| C. | 已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液.当Pb(CH3COO)2溶液中通入H2S气体时有黑色沉淀生成:Pb2++H2S=PbS↓+2H+ | |
| D. | CuSO4溶液与过量浓氨水反应:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钾溶液和稀硝酸反应 | B. | 氢氧化镁和稀稀盐酸反应 | ||
| C. | Ba(OH)2溶液滴入稀硫酸中 | D. | 二氧化碳通入澄清石灰水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
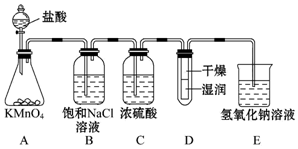
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com