
| A.NH4NO3、NaOH中既有离子键,又有极性共价键,其中NH4NO3中还有配位键 |
| B.水的沸点是100℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7℃,引起这种差异的主要原因是水分子间有氢键 |
| C.范德华力与氢键可同时存在于分子之间 |
| D.氢键比范德华力强,且氢键是一种特殊的化学键 |
科目:高中化学 来源:不详 题型:填空题

 )中含有σ键的数目为_________个。
)中含有σ键的数目为_________个。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
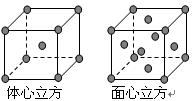
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.构成离子晶体的作用力可能是离子键也可能是共价键 |
| B.氯化铯晶体是由氯化铯分子构成的 |
| C.由于离子的带电量有限,一个离子可以同时吸引的带相反电荷的离子数也有限 |
| D.一种离子化合物如果适合作耐高温材料,它的晶格能一定相当大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢气、氮气、氧气、氯气 | B.氟化氢、氯化氢、溴化氢 |
| C.锂、钠、钾、铷、铯 | D.氯化钾、溴化钾、碘化钾 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.热稳定性:PH3>H2S>HBr>NH3 |
| B.物质的熔点:石英>食盐>冰>汞 |
| C.结合质子的能力:CO32->CH3COO->SO42- |
| D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCI3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢键比范德华力强,所以它属于化学键 |
| B.分子间形成的氢键使物质的熔点和沸点升高 |
| C.含氢原子的物质之间均可形成氢键 |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


 与
与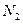 结构相似,推算HCN分子中
结构相似,推算HCN分子中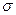 键与
键与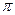 键数目之比为 。
键数目之比为 。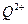 的未成对电子数是 。
的未成对电子数是 。 的水溶液中,一定条件下存在组成为
的水溶液中,一定条件下存在组成为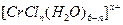 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应: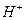 经中和滴定,即可求出x和n,确定配离子的组成。
经中和滴定,即可求出x和n,确定配离子的组成。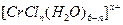 的溶液,与R-H完全交换后,中和生成的
的溶液,与R-H完全交换后,中和生成的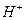 需浓度为0.1200 mol
需浓度为0.1200 mol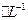 NaOH溶液25.00 ml,呆知该配离子的化学式为 。
NaOH溶液25.00 ml,呆知该配离子的化学式为 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com