
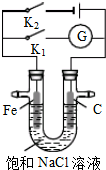
| A. | 只闭合K1,电流计G指针不发生偏转 | |
| B. | 只闭合K1,石墨棒周围溶液pH逐渐降低 | |
| C. | 只闭合K2,电路中通过0.1mol电子时,两极共产生2.24L气体 | |
| D. | 只闭合K2,铁棒上发生的反应为:2H2O+2e-═H2↑+2OH- |
分析 若闭合K1,该装置没有外接电源,所以构成了原电池;组成原电池时,较活泼的金属铁作负极,负极上铁失电子发生氧化反应;石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应;
若闭合K2,该装置有外接电源,所以构成了电解池,Fe与负极相连为阴极,碳棒与正极相连为阳极,以此解答该题.
解答 解:A.若闭合K1,该装置没有外接电源,所以构成了原电池,较活泼的金属铁作负极,石墨棒作正极,正极上氧气得电子生成氢氧根离子,有电流通过导线,所以电流计G指针发生偏转,故A错误;
B.若闭合K1,该装置没有外接电源,所以构成了原电池;不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,所以石墨棒周围溶液pH逐渐升高,故B错误;
C.没有说明是否是标准状况下,所以无法计算气体的体积,故C错误;
D.K2闭合,Fe与负极相连为阴极,阴极上水电离的氢离子得电子生成氢气,其电极反应为:2H2O+2e-═H2↑+2OH-,故D正确.
故选D.
点评 本题考查了原电池原理和电解池原理,侧重于学生的分析能力的考查,能正确判断电池的类型及两极的反应是解本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 将体积缩小为原来的一半,当体系再次达到平衡时,C02的浓度为原来的2倍 | |
| B. | CaCO3(s)加热分解生成Ca0(s)和C02,△s<0 | |
| C. | 将体积增大为原来的2倍,再次达到平衡时,气体密度不变 | |
| D. | 保持容器体积不变,充入He,平衡向逆反应方向进行. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内2amol A生成,同时生成3amol B | |
| B. | A、B、C的浓度不再变化 | |
| C. | 混合气体的总压强不再变化 | |
| D. | A、B、C的分子数目比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 处理过程中银器一直保持恒重 | |
| B. | 银器为正极,Ag2S被氧化生成单质银 | |
| C. | 该过程中总反应为2Al+3Ag2S═6Ag+Al2S3 | |
| D. | 黑色褪去的原因是黑色Ag2S转化为白色Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g 5.00% 的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.99%,乙中c电极质量增加,据此回答问题:
如图所示装置中,甲,乙、丙三个烧杯依次分别盛放100g 5.00% 的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.99%,乙中c电极质量增加,据此回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.2 g Fe投入到400 mL 1 mol/L的硝酸中充分反应,转移电子总数为0.2 NA | |
| B. | 标准状况下,11.2 L C2H6含3 NA个C-H极性共价键 | |
| C. | 标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 NA | |
| D. | 标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液与足量氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 用醋酸除水垢:2CH3COOH+CaCO3═2CH3COO-+Ca2++H2O+CO2↑ | |
| C. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| D. | SO2通入碘水中,反应的离子方程式为:SO2+I2+2H2O═SO32-+2I-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com