
| A.碳化硅化学性质稳定,可用于生产耐高温水泥 |
| B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料———光导纤维 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,故在玻璃尖口点燃H2时出现黄色火焰 |

| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
 Si(s) + 3HCl(g), 不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如右图所示。下列说法正确的是________(填字母序号)。
Si(s) + 3HCl(g), 不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如右图所示。下列说法正确的是________(填字母序号)。

 ;c项中,SiHCl3沸点低,实际生产中为提高SiHCl3的利用率,应适当升高温度。
;c项中,SiHCl3沸点低,实际生产中为提高SiHCl3的利用率,应适当升高温度。

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.都是常用的干燥剂 |
| B.分别露置在空气中,容器内溶质的物质的量浓度都降低 |
| C.常温下都可以储存于铝罐中 |
| D.一定条件下和铜反应中都表现出强氧化性和强酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.CO2 + 3H2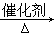 CH3OH +H2O CH3OH +H2O |
B.6CO2 + 6H2O C6H12O6 + 6O2 C6H12O6 + 6O2 |
C.CO2 + CH4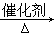 CH3COOH CH3COOH |
D.2CO2 + 6H2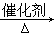 CH2=CH2 + 4H2O CH2=CH2 + 4H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
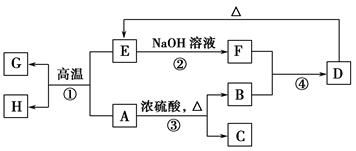
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.高温下二氧化硅与碳酸钠反应放出二氧化碳,说明硅酸(H2SiO3)的酸性比碳酸强 |
| B.陶瓷、玻璃、水泥容器都能贮存氢氟酸 |
| C.石灰抹墙、水泥砌墙的硬化过程原理相同 |
| D.玻璃窑中出来的气体的主要成分是二氧化碳 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制普通玻璃的原料主要是纯碱、石灰石和石英砂 |
| B.玻璃在加热熔化时有固定的熔点 |
| C.普通玻璃的主要成分中有硅酸钠、硅酸钙 |
| D.盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅反应生成硅酸钠而使瓶塞与瓶口黏在一起 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2SiO3 | B.Na2CO3、Na2SiO3 | C.Na2CO3、SiO2 | D.SiO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com