
| A、高纯硅是良好的半导体 |
| B、硅是制造太阳能电池的常用材料 |
| C、单质硅既不能与酸反应又不能与碱反应 |
| D、硅在地壳中含量居第二位,但在自然界中没有游离态的硅存在 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、向AlCl3溶液中加过量的NaOH溶液 |
| B、向NaAlO2溶液中加过量的盐酸 |
| C、向AlCl3溶液中通入过量的CO2 |
| D、向NaAlO2溶液中通入过量的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
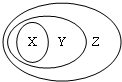 用图表示的一些物质或概念间的从属关系中不正确的是( )
用图表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | |
| A | 氧化物 | 化合物 | 纯净物 |
| B | 电解质 | 盐 | 化合物 |
| C | 胶体 | 分散系 | 混合物 |
| D | 酸性氧化物 | 非金属氧化物 | 氧化物 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、[HA]<[A-] |
| B、[HA]一定大于0.1 mol?L-1 |
| C、[Na+]=[HA]+[A-] |
| D、2[OH-]=2[H+]+[HA]-[A-] |
查看答案和解析>>
科目:高中化学 来源: 题型:
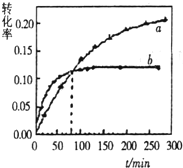 丙酮(CH3COCH3)在某溶剂里,在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq)取相同浓度的CH3COCH3,分别在40℃和60℃时,测得其转化率α随时间变化的关系曲线(α-t)如图所示.下列说法正确的是( )
丙酮(CH3COCH3)在某溶剂里,在催化剂作用下发生反应:2CH3COCH3(aq)?CH3COCH2COH(CH3)2(aq)取相同浓度的CH3COCH3,分别在40℃和60℃时,测得其转化率α随时间变化的关系曲线(α-t)如图所示.下列说法正确的是( )| A、b代表40℃时CH3COCH3的α-t曲线 |
| B、升高温度可缩短该反应达平衡的时间并能提高平衡转化率 |
| C、增大压强可缩短该反应达平衡的时间并能提高平衡转化率 |
| D、上述反应的逆反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B、两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 |
| C、常温下物质的量浓度相等的①(NH4)2CO3、②NH4HSO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):③>①>② |
| D、pH=5的硫酸溶液稀释到原来的500倍,稀释后溶液中c(SO42-)与c(H+)之比约为1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ |
| C、①②③④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com