
分析 CH3COOH是弱酸部分电离,电离时电离出自由移动的氢离子和醋酸根离子;加入与弱电解质电离出相同离子的电解质抑制电离,消耗弱电解质电离出的离子,促进电离,温度不变,醋酸的电离平衡常数不变,以此来解答.
解答 解:CH3COOH是弱酸,在溶液中部分电离,其电离方程式为:CH3COOH?CH3COO-+H+,加入少量NaOH固体,电离出的氢氧根离子与CH3COOH电离生成的H+结合,使电离平衡正向移动,CH3COOH的电离度增大,弱电解质的电离为吸热过程,升高温度,电离平衡常数增大,温度不变,醋酸的电离平衡常数不变,所以该乙酸溶液电离平衡常数不变,
故答案为:CH3COOH?CH3COO-+H+;右;增大;不变.
点评 本题考查乙酸的电离,明确影响平衡移动的因素即可解答,注意加入与弱电解质电离出相同离子的电解质抑制电离,消耗弱电解质电离出的离子,电离平衡常数受温度影响,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

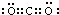 、
、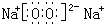 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com