
| pH值 | Mg(OH)2 | Mn(OH)2 | MnO(OH)2 | Fe(OH)2 | Al(OH)3 | Fe(OH)3 |
| 开始沉淀时 | 9.3 | 7.1 | 7.8 | 7.6 | 3.7 | 2.3 |
| 沉淀完全时 | 10.8 | 10.8 | 9.8 | 9.6 | 4.7 | 3.7 |
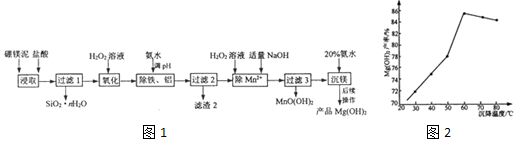
分析 以硼镁泥(主要成分为MgSiO3、Fe2O3及少量Al2O3、FeO和MnO)为原料制备高纯Mg(OH)2的流程:加入盐酸浸取,MgSiO3、Fe2O3及少量Al2O3、FeO和MnO都和硫酸反应,其中MgSiO3发生反应MgSiO3+2HCl+(n-l)H2O=MgCl2+SiO2•nH2O,生成的SiO2•nH2O过滤,滤液中含有Mg2+、Fe3+、Fe2+、Mn2+、Al3+,加入双氧水溶液把亚铁离子氧化成铁离子,加氨水调节pH,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤,滤渣2含有Fe(OH)3、Al(OH)3,向滤液中加入双氧水双氧水和适量氢氧化钠发生反应Mn2++H2O2+2OH-=MnO(OH)2↓+H2O,过滤除去锰离子,少量镁离子被沉淀,过滤3所得滤渣中含有MnO(OH)2和Mg(OH)2,向滤液中加入20%的氨水沉淀镁离子,过滤洗涤沉淀,得到产品,据此分析解答.
解答 解:(1)“浸取”时,将硼镁泥制成浆料、用盐酸多次浸取可提高镁的浸取率,故答案为:ac;
(2)由流程可知,“浸取”时,MgSiO3与盐酸反应生成SiO2•nH2O,化学方程式为:MgSiO3+2HCl+(n-l)H2O=MgCl2+SiO2•nH2O;
故答案为:MgSiO3+2HCl+(n-l)H2O=MgCl2+SiO2•nH2O;
(3)“除铁、铝”时,需调节溶液pH的目的是使铁离子、铝离子沉淀完全,但不能使锰离子、镁离子沉淀,由图表可知pH范围为:4.7<pH<7.1;
故答案为:4.7<pH<7.1;
(4)“除Mn2+”时发生反应锰离子生成MnO(OH)2沉淀除去,离子方程式为:Mn2++H2O2+2OH-=MnO(OH)2↓+H2O;除锰过程加入氢氧化钠,少量镁离子沉淀,故过滤3所得滤渣中含有MnO(OH)2和Mg(OH)2;
故答案为:Mn2++H2O2+2OH-=MnO(OH)2↓+H2O;Mg(OH)2;
(5)当温度超过60℃,随温度再升高,氨水挥发加剧,导致溶液中氨水浓度降低,Mg(OH)2产率反而降低,
故答案为:氨水挥发加剧,导致溶液中氨水浓度降低.
点评 本题考查了物质的制备,涉及对工艺流程的理解、氧化还原反应、对条件的控制选择与理解等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 2NaBr+Cl2═Br2+2NaCl | |
| B. | AlCl3+3NaAlO2+6H2O═4Al(OH)3↓+3NaCl | |
| C. | 2H2S+SO2═3S↓+2H2O | |
| D. | Cl2+H2O═HCl+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Na+、OH-、Cl- | B. | Ag+、K+、Cl-、NO3- | ||
| C. | Cu2+、NO3-、SO42-、Cl- | D. | Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、K+、CO32-、Cl- | B. | Al3+、Cu2+、S2-、Cl- | ||
| C. | NH4+、Cu2+、Cl-、NO3- | D. | Fe3+、K+、SCN-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度比空气小 | |
| B. | 是无色无味的气体 | |
| C. | SO2能使溴水褪色,说明SO2具有漂白性 | |
| D. | 某生产硫酸厂区紫罗兰花变成白色,说明其周围空气中可能含较高浓度SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶于足量稀 HNO3 中:Fe3O4+8H+═Fe2++ZFe3++4H2O | |
| B. | NH4HCO3溶液与足量 NaOH 溶液混合:HCO3-+OH-═CO32-+H2O | |
| C. | 将过量的 SO2 通入 NaClO 溶液中:SO2+ClO-+H2O═HClO+HSO3- | |
| D. | 将 0.2mol•L-1KA1(SO4)2 溶液与 0.3mol•L-1Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
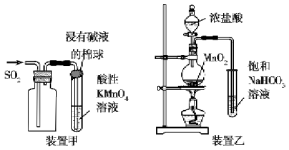
| A. | 装置甲收集SO2并验证其漂白性 | |
| B. | 装置乙验证氯气与水反应有盐酸生成 | |
| C. | 为河定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照 | |
| D. | 证明Fe3-的氧化性大于Ⅰ2将KI溶液和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置,下层溶液显紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用淀粉检验加碘食盐中是否含有碘元素 | |
| B. | 适量饮酒对身体有利的原因是酒精不能使蛋白质变性 | |
| C. | PM2.5亦称可入肺颗粒物,表面积大,能吸附有毒有害物质 | |
| D. | 使用生物酶降解生活污水中的有机物,可以防止水体富营养化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向待检液中加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定含有SO42- | |
| B. | 向待检液中加入NaOH溶液并加热,有能使湿润的红色石蕊试纸变蓝的气体生成,则原溶液中一定含有NH4+ | |
| C. | 向待检液中加入盐酸有能使澄清石灰水变浑浊的气体生成,则原溶液中一定含有大量的CO32- | |
| D. | 向待检液中加入几滴氯水,再加入KSCN溶液,溶液立即变红,则原溶液中一定含有Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com