
| A. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H<0 | |
| B. | SO2的催化氧化反应是一个放热反应,所以升高温度时,正反应速率减慢 | |
| C. | 反应CaCO3(s)=CaO(s)+CO2(g)的△S<0 | |
| D. | FeCl3与KSCN反应达到平衡时,加入KCl溶液,则溶液颜色变深 |
分析 A、反应能否自发进行,决定于有△H-T△S.
B、升高温度,反应速率加快;
C、反应物中无气体,生成物中有气体,故△S>0;
D、溶液中存在平衡Fe3++SCN-?Fe(SCN)2+.
解答 解:A、反应物中有气体,生成物中没有气体,故△S<0,若要使反应自发进行,△H-T△S<0,则△H必须小于0,故A正确;
B、SO2的催化氧化是一个放热反应,但升高温度,反应速率加快,故B错误;
C、反应物中无气体,生成物中有气体,故△S>0,故C错误;
D、溶液中存在平衡Fe3++SCN-?Fe(SCN)2+,滴入少量滴加KCl溶液,对溶液体积基本不影响,不影响平衡体系中各离子的浓度,平衡不移动,颜色不变,若加入大量的KCl溶液,平衡体系中各离子的浓度都降低,溶液颜色变浅,且平衡向左移动,故D错误;
故选A.
点评 本题考查化学反应速率的影响因素、反应方向的判断、可逆反应等,难度不大,注意D中平衡移动可以借助平衡常数理解.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
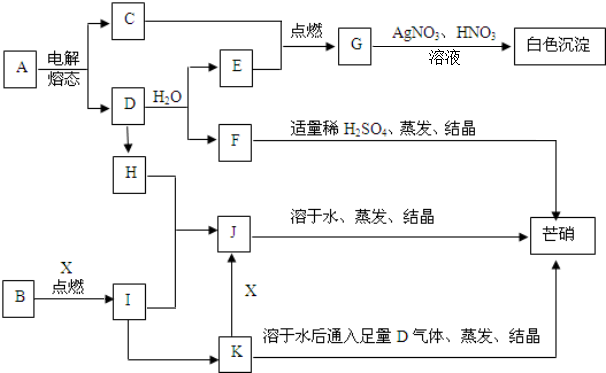
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和热测定时,用浓硫酸代替盐酸与NaOH溶液反应 | |
| B. | 用25mL碱式滴定管准确量取25.00mLKMnO4 标准溶液 | |
| C. | 用玻璃棒蘸取0.10 mol•L-1CH3COOH溶液点在用水湿润的广泛pH试纸上,测定该溶液的pH=3.2 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL5%H2O2和1mLH2O,向另一支试管中加入2mL5%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol•L-1,则反应的△H<0 | |
| B. | 若在2 L恒容绝热(与外界无热量交换)密闭容器中进行该反应,化学平衡常数不变 | |
| C. | 保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO, 反应达到平衡前的速率:v(正)<v(逆) | |
| D. | 保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向含有0.4mol FeBr2的溶液中通入0.3mol Cl2充分反应:4Fe2++2Br-+3Cl2═4Fe3++6Cl-+Br2 | |
| B. | 磁性氧化铁溶于氢碘酸:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| C. | 放置在空气中的淀粉碘化钾溶液一段时间后溶液呈蓝色:4H++4I-+O2═2I2+2H2O | |
| D. | 向硝酸铵溶液中滴加NaOH溶液:NH4++OH-═NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com