
| A组 | B组 |
| Ⅰ.H-I键的键能大于H-Cl键的键能 Ⅱ.H-I键的键能小于H-Cl键的键能 Ⅲ.H-I键的键能小于H-Cl键的键能 Ⅳ.HI分子间作用力小于HCl分子间作用力 | ①HI比HCl稳定 ②HCl比HI稳定 ③HI沸点比HCl低 ④HI沸点比HCl低 |
| A. | Ⅰ① | B. | Ⅱ② | C. | Ⅲ③ | D. | Ⅳ④ |
分析 根据键能越大,物质的热稳定性越强;根据组成和结构相似的分子,相对分子质量越大,分子间作用力越强,物质的熔沸点越高,以此解答该题.
解答 解:A.HCl比HI稳定,A、B组说法都不正确,故A错误;
B.HCl比HI稳定,是由于H-Cl键键能大于H-I键键能,故B正确;
C.HI沸点比HCl高,是由于HI的相对分子质量大于HCl的相对分子质量,与键能大小无关,故C错误;
D.HI的相对分子质量大于HCl的相对分子质量,HI分子间作用力大于HCl分子间作用力,故D错误;
故选B.
点评 本题主要考查了键能与物质的热稳定性、相对分子质量与物质的熔沸点之间的关系,为高频考点,侧重于学生的分析能力以及双基的考查,注意相关基础知识的积累,难度不大.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题



 +2H2O.
+2H2O.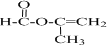 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
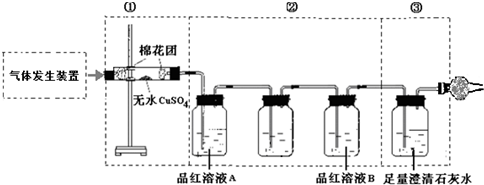
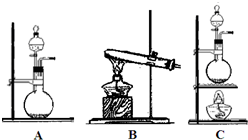
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
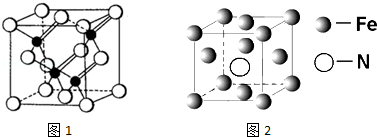
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
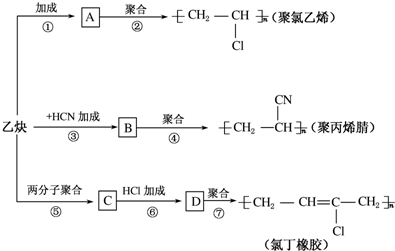
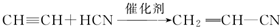 ;
;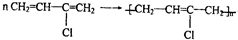 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
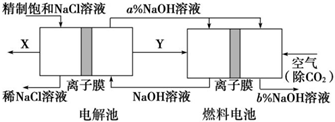
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com