
| A. | FeBr3作催化剂,苯和溴水发生反应可生成无色、比水重的液体溴苯 | |
| B. | 用盐酸酸化的高锰酸钾溶液区别苯与甲苯 | |
| C. | 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,实现乙醇被氧化为乙醛的实验 | |
| D. | 可以用水鉴别硝基苯、乙醇、四氯化碳三种有机物 |
分析 A.苯和溴水不反应;
B.甲苯能被高锰酸钾氧化,苯不能;
C.Cu与氧气反应生成CuO,CuO氧化乙醇生成乙醛;
D.硝基苯、四氯化碳均不溶于水,密度均比水大.
解答 解:A.苯和溴水不反应,应利用苯、液溴发生取代反应制备溴苯,故A错误;
B.甲苯能被高锰酸钾氧化,苯不能,则用盐酸酸化的高锰酸钾溶液区别苯与甲苯,故B正确;
C.铜丝弯成螺旋状,在酒精灯上加热变黑后,Cu与氧气反应生成CuO,将立即伸入盛有无水乙醇的试管中,CuO氧化乙醇生成乙醛,则实现乙醇被氧化为乙醛的实验,故C正确;
D.硝基苯、四氯化碳均不溶于水,密度均比水大,与水混合的分层现象相同,不能鉴别,故D错误;
故选BC.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机物鉴别时的现象,题目难度不大.


科目:高中化学 来源: 题型:填空题
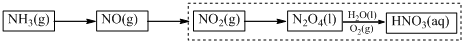
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是4He的同分异构体 | B. | 比 4He少一个中子 | ||
| C. | 比4He少一个质子 | D. | 3He原子核有3个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| a | b | c | |
| A | SiO2 | Na2SiO3 | H2SiO3 |
| B | NO | NO2 | HNO3 |
| C | Fe | FeCl3 | Fe(OH)3 |
| D | Al(OH)3 | Na[Al(OH)4] | Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SbCl4 | PbCl4 |
| 熔点/℃ | -90.4 | -70.4 | 5.2 | 120 | -70.4 | -49.5 | -36.2 | -15 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 各物质的质量保持不变 | B. | 各物质的浓度相等 | ||
| C. | v(逆)=v(正),正、逆反应停止 | D. | X、Y、Z的速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
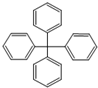
| A. | 其分子式为C25H20 | |
| B. | 分子内的所有碳原子可能共平面 | |
| C. | 完全燃烧生成CO2和H2O的物质的量之比为5:2 | |
| D. | 此分子的一氯代物有三种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、SO42-、I-、K+ | B. | K+、Al3+、SO42-、MnO4- | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | Ba2+、NH4+、Br-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com