
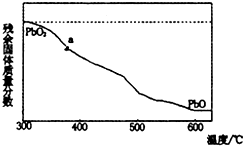
 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3分析 (1)a点残余固体质量分数为96.66%,则残余固体质量为478g×99.66%,加热过程中Pb元素质量不变,则Pb元素物质的量为478g÷239g/mol=2mol,残留固体中O元素质量为478g×99.66%-2mol×207g/mol=48g,则O原子物质的量为48g÷16g/mol=3,Pb、O原子数目之比为2:3,故a点化学式为Pb2O3,相当于PbO2、PbO按物质的量1:1混合,由题目信息可知,Pb2O3与硝酸反应生成PbO2、Pb(NO3)2与水;
(2)①CH3COOH一CH3COONa溶液中PbO2与KI全部反应而溶解,得到棕色溶液,说明生成碘单质,PbO2被还原生成醋酸铅,还生醋酸钾与水;
②PbO2具有强氧化性,可以将盐酸中氯离子氧化为氯气,同时生成PbCl2与水;酸性条件下Na2S2O3会反应得到S、SO2;
③分离互不相溶的固体与液体,应采取过滤方法,并需要洗涤、干燥,所得固体相当于PbO2、PbO的混合物,根据PbO2~I2~2Na2S2O3计算PbO2的物质的量,再根据PbO~Pb(NO3)2~PbCrO2计算PbO的物质的量,进而确定固体化学式.
解答 解:(1)a点残余固体质量分数为96.66%,则残余固体质量为478g×99.66%,加热过程中Pb元素质量不变,则Pb元素物质的量为478g÷239g/mol=2mol,残留固体中O元素质量为478g×99.66%-2mol×207g/mol=48g,则O原子物质的量为48g÷16g/mol=3,Pb、O原子数目之比为2:3,故a点化学式为Pb2O3,相当于PbO2、PbO按物质的量1:1混合,由题目信息可知,Pb2O3与硝酸反应生成PbO2、Pb(NO3)2与水,反应方程式为:Pb2O3+2HNO3=PbO2+Pb(NO3)2+H2O,
故答案为:Pb2O3;Pb2O3+2HNO3=PbO2+Pb(NO3)2+H2O;
(2)①CH3COOH一CH3COONa溶液中PbO2与KI全部反应而溶解,得到棕色溶液,说明生成碘单质,PbO2被还原生成醋酸铅,还生醋酸钾与水,反应方程式为:PbO2+2KI+4CH3COOH=(CH3COO)2Pb+2CH3COOK+I2+2H2O,
故答案为:PbO2+2KI+4CH3COOH=(CH3COO)2Pb+2CH3COOK+I2+2H2O;
②PbO2具有强氧化性,可以将盐酸中氯离子氧化为氯气,同时生成PbCl2与水,反应方程式为:PbO2+4HCl=PbCl2+Cl2↑+H2O,
酸性条件下Na2S2O3会反应得到S、SO2,反应方程式为:Na2S2O3+2CH3COOH=2CH3COONa+S↓+SO2↑+H2O,
故答案为:PbO2+4HCl=PbCl2+Cl2↑+H2O;Na2S2O3+2CH3COOH=2CH3COONa+S↓+SO2↑+H2O;
③采取过滤方法分离出固体,再洗涤、干燥,所得固体相当于PbO2、PbO的混合物,
根据PbO2~I2~2Na2S2O3,可知n(PbO2)=$\frac{1}{2}$n(Na2S2O3)=$\frac{1}{2}$×0.02L×0.2mol/L=0.002mol,根据PbO~Pb(NO3)2~PbCrO2,可知n(PbO)=n(PbCrO2)=$\frac{0.969g}{323g/mol}$=0.003mol,故PbO2、PbO的物质的量之比为0.002mol:0.003mol=2:3,则固体化学式为Pb5O7,
故答案为:过滤、洗涤、干燥;Pb5O7.
点评 本题考查化学方程式计算、物质组成测定等,是对学生综合能力的考查,注意知识的迁移应用是关键,难度中等,试题培养了学生的灵活应用能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | pH相同的①CH3COONa、②NaHCO3、③C6H5ONa,三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)═2c(A2-)+c(HA-)+c(H2A) | |
| C. | 在电解食盐水的实验中,若电解后溶液总体积为1L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为12 | |
| D. | 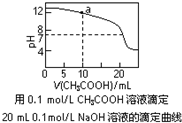 如图中a点溶液中各离子浓度的关系是:c(OH-)═c(H+)+c(CH3COO-)+2c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
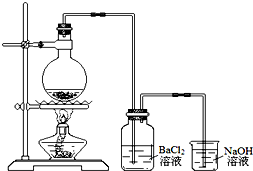 某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.
某学习小组探究铜跟浓硫酸反应的情况.取6.4g铜片和10mL 18mol•L-1的浓硫酸放在圆底烧瓶中,按如图所示装置进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C生成的速率与C分解的速率不相等 | |
| B. | A、B、C的浓度不再变化 | |
| C. | 单位时间生成nmolA,同时生成3nmolB | |
| D. | A、B、C的分子数之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | B. | c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | ||
| C. | c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | D. | c(Na+)+c(OH-)=c(CH3COO-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将25gKCl溶液蒸干得到5gKCl固体,则原溶液中溶质的质量分数为20% | |
| B. | 某物质中只含有一种元素,则该物质一定是纯净物 | |
| C. | 只有一种元素的阳离子和一种元素的阴离子构成的物质一定是纯净物 | |
| D. | 盐形成的溶液中,既不能电离出H+,也不能电离出OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com