
【题目】配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因有( )
A.NaOH固体放在滤纸上称量
B.NaOH固体中混有Na2O杂质
C.摇匀后发现液面低于刻度线,加水至刻度线
D.有少量NaOH溶液残留在烧杯中
科目:高中化学 来源: 题型:
【题目】对于某些离子的检验及结论一定正确的是
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO![]()
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO![]()
C. 加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,一定有NH![]()
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于______________(用字母代号填写)
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)SO2与O2的混合气体中,氧元素的质量分数为70%,则SO2与O2的物质的量之比是__________,这种混合气体的密度是同温同压下氧气密度的_____倍。
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的物质的量为_________mol,
(4)将反应后所得到的CuSO4溶液与足量Ba(OH)2溶液充分反应的离子方程式是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是配制100mL2mol·L-1的NaOH的溶液过程示意图:
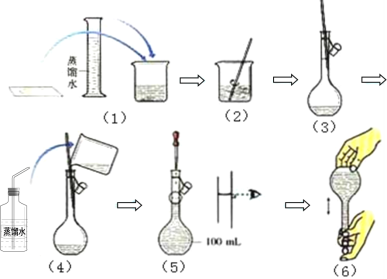
(1)步骤(3)(4)(5)(6)都涉及同一仪器,此仪器的名称为___。
(2)配制此溶液时,需称取NaOH固体的质量为___g。
(3)步骤(6)操作后,发现液面下降,这时___(填“需要”或“不需要”)再加水至刻度线。
(4)实验时,如果没有步骤(4)的操作,所得溶液的物质的量浓度将___;定容时俯视刻度会导致浓度___(填“偏高”“不变”或“偏低)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA。下列说法正确的是
A.12g金刚石中含有的共价键数目为4NA
B.3.2gCu与足量浓硝酸反应生成的气体分子数为0.1NA
C.标准状况下,2.24LCH3OH中含有的电子数为1.8NA
D.常温常压下,4.4gN2O和CO2的混合气体中含有0.3NA个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
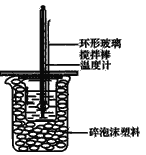
(1)如果将环形玻璃搅拌棒改为环形金属(如铜)棒,对求得中和热数值的影响是___(填“偏高”、“偏低”或“无影响”)。
(2)如果改用60mL1.0mol·L-1盐酸跟50mL 1.1mol·L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量___(填“增加”、“减少”或“不变”),所求中和热数值___(填“增加”、“减少”或“不变”);
(3)不能用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是____;
(4)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据。
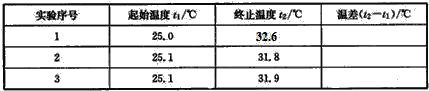
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容C=4.184×10-3kJ/(g.℃),则该反应的中和热为△H=____(保留小数点后一位)。
(5)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已达到平衡的可逆反应,增大压强后,反应速率(v)变化如图所示。该反应是

A. N2(g)+3H2(g) ![]() 2NH3(g)B. C(s)+H2O(g)
2NH3(g)B. C(s)+H2O(g) ![]() CO(g)+H2(g)
CO(g)+H2(g)
C. H2(g)+I2(g) ![]() 2HI(g)D. Fe3+(aq)+3SCN-(aq)
2HI(g)D. Fe3+(aq)+3SCN-(aq) ![]() Fe(SCN)3(aq)
Fe(SCN)3(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中A、B属于盐,C属于碱,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)C的化学式为___。
(2)A溶液与B溶液反应可生成气体,则该反应的离子方程式为___。
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸。
①B的化学式为___,鉴别溶液中B的阴离子的试剂为___。
②D溶于稀硝酸的离子方程式为___。
③D与E的混合物ag,加入足量盐酸,完全反应生成的气体在标准状况下体积为VL,则E在混合物中的质量分数的表达式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com