
分析 I 温室气体的成分为二氧化碳,则乙为CO2,加入过量稀硫酸产生二氧化碳气体,则溶液甲中含有碳酸根或碳酸氢根,溶液丙中加入过量氨水生成白色沉淀,溶液中可能含有铝离子或者镁离子,据此答题;
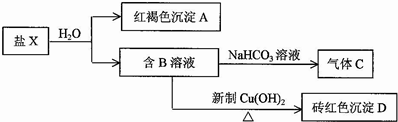
II.物质B是最简单的羧酸,则B为HCOOH,盐X与水反应生成红褐色沉淀A为Fe(OH)3和HCOOH,则盐X为Fe(HCOO)3;甲酸与碳酸氢钠反应生成C为CO2,甲酸与氢氧化铜反应生成D为Cu2O,据此答题.
解答 解:I 温室气体的成分为二氧化碳,则乙为CO2,加入过量稀硫酸产生二氧化碳气体,则溶液甲中含有碳酸根或碳酸氢根,溶液丙中加入过量氨水生成白色沉淀,溶液中可能含有铝离子或者镁离子,
(1)乙为CO2,结构式为O=C=O,
故答案为:O=C=O;
(2)加入过量浓硫酸产生二氧化碳气体,则溶液中含有碳酸根或碳酸氢根,溶液甲一定不能共存的离子是Fe3+,
故选A;
(3)溶液丙中加入过量氨水生成白色沉淀,溶液中可能含有铝离子或者镁离子,方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+(Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+),
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+(Mg2++2NH3•H2O=Mg(OH)2↓+2NH4+);
II.物质B是最简单的羧酸,则B为HCOOH,盐X与水反应生成红褐色沉淀A为Fe(OH)3和HCOOH,则盐X为Fe(HCOO)3;甲酸与碳酸氢钠反应生成C为CO2,甲酸与氢氧化铜反应生成D为Cu2O,
(1)甲酸与碳酸氢钠反应生成二氧化碳,反应方程式为HCO3-+HCOOH=CO2↑+H2O+HCOO-,
故答案为:HCO3-+HCOOH=CO2↑+H2O+HCOO-;
(2)根据上面的分析可知,X为Fe(HCOO)3,
故答案为:Fe(HCOO)3;
(3)氢氧化铁与甲酸发生氧化还原反应的方程式为2Fe(OH)3+5HCOOH=CO2↑+6H2O+2Fe(HCOO)2,原因是三价铁具有强氧化性,氧化性大于铜离子,甲酸中的醛基具有还原性,二者能发生氧化还原反应,
故答案为:2Fe(OH)3+5HCOOH=CO2↑+6H2O+2Fe(HCOO)2;三价铁具有强氧化性,氧化性大于铜离子,甲酸中的醛基具有还原性,二者能发生氧化还原反应;
(4)D为Cu2O,检验砖红色沉淀中含有铜的方法是取一定量的氧化亚铜样品,溶于足量的稀硫酸中,过滤、洗涤、干燥后称重,与等质量纯氧化亚铜的计算量对比,若质量偏大,则样品中含有单质铜,
故答案为:取一定量的氧化亚铜样品,溶于足量的稀硫酸中,过滤、洗涤、干燥后称重,与等质量纯氧化亚铜的计算量对比,若质量偏大,则样品中含有单质铜;
点评 本题考查了物质的性质与推断,涉及结构式、离子反应、离子共存、离子检验等知识,中等难度,物质的推断是解题的关键,注意元素化合物知识的综合应用.


科目:高中化学 来源: 题型:选择题
| 选项 | a中试剂 | b中试剂 | 实验现象 |  |
| A | 1mL12mol•L-1浓盐酸0.5gMnO2 | 0.1gCaCO3、1mL 2mol•L-1盐酸 | 红墨水褪色,U形管中液面左右基本持平 | |
| B | 0.1gNa3mol水 | 0.1gNa 3mol乙醇 | 反应开始阶段,反应结束静置一段时间后U形管中液面都是左低右高 | |
| C | 3mL浓硫酸、铁钉 | 3mLNaCl溶液、铁钉 | 铁钉均生锈,U形管中液面左高右低 | |
| D | 3mL水 | 3mL饱和FeSO4溶液 | 一段时间后,U形管中液面左低右高,b管溶液中出现红褐色浑浊物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
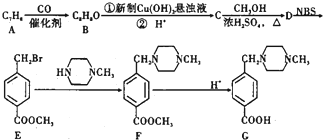

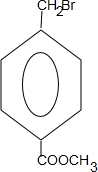 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$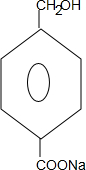 +CH3OH+NaBr
+CH3OH+NaBr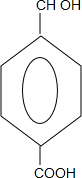 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$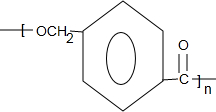 +nH2O
+nH2O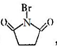 ,则关于NBS与D反应生成E的 说法错误的是 ( )
,则关于NBS与D反应生成E的 说法错误的是 ( )查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铯碱性强于氢氧化钠 | |
| B. | 碱金属单质从Li到Cs,熔点依次升高 | |
| C. | 碱金属单质均为银白色,从Li到Cs,密度逐渐增大 | |
| D. | 碱金属元素形成的阳离子,从Li+到Cs+,氧化性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;B与空气反应的化学方程式2NO+O2=2NO2.
;B与空气反应的化学方程式2NO+O2=2NO2.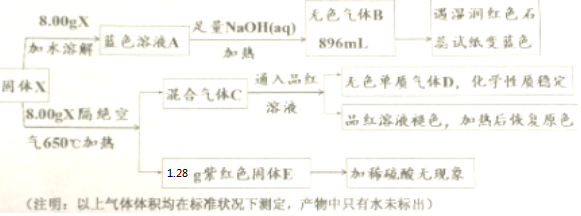
 ;气体D的结构式
;气体D的结构式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、丙醇 | B. | 乙醇、乙二醇 | C. | 1-丙醇、2-丙醇 | D. | 乙烯、乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、CO2 | B. | MgF2、H2O2 | C. | NaOH、Ba(OH)2 | D. | NaCl、KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 或
或 或CH2=CHCH2OH.
或CH2=CHCH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素为碳 | B. | 该元素的气态氢化物含H 25% | ||
| C. | RO2为极性分子 | D. | RO2与水反应能生成酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com