


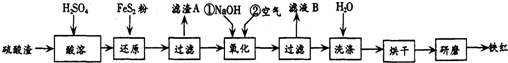
分析 大理石含杂质铁的氧化物,加入稀盐酸溶解得到氯化钙、氯化铁溶液,加入氨水沉淀铁离子,过滤得到滤渣主要为氢氧化铁,滤液中加入碳酸铵沉淀钙离子过滤得到沉淀碳酸钙,反应①是逐滴加入稀盐酸,至溶液中尚存有少量固体.将溶液煮沸,趁热过滤.将溶液煮沸的作用是除去溶液中溶解的CO2,反应②滤液中加入氨水和过氧化氢冰水浴中反应生成过氧化钙晶体,过滤得到过氧化钙晶体,水洗、乙醇洗、烘烤得到过氧化钙固体,
(1)大理石中含铁的氧化物,沉淀溶解沉淀、过滤、再沉淀、再过滤目的是除去杂质离子;过滤装置有烧杯、玻璃棒、漏斗;
(2)将溶液煮沸的作用是除去溶液中二氧化碳;
(3)反应②是滤液中加入氨水和过氧化氢冰水浴中反应生成过氧化钙晶体;过氧化氢热易分解;
(4)白色晶体水洗时,表面可能粘有氯离子,结合氯离子的检验方法设计实验检验;过氧化钙较稳定,不溶于乙醇;
(5)制备过氧化钙的另一种方法是:将石灰石锻烧后.直接加人双氧水反应,过滤后可得到过氧化钙产品混有杂质;
(6)二氧化碳和过氧化钙发生反应生成碳酸钙,过氧化钙分解生成氧化钙和氧气,结合生成的氧气物质的量计算过氧化钙物质的量得到质量来计算过氧化钙的质量分数.
解答 解:大理石含杂质铁的氧化物,加入稀盐酸溶解得到氯化钙、氯化铁溶液,加入氨水沉淀铁离子,过滤得到滤渣主要为氢氧化铁,滤液中加入碳酸铵沉淀钙离子过滤得到沉淀碳酸钙,反应①是逐滴加入稀盐酸,至溶液中尚存有少量固体.将溶液煮沸,趁热过滤.将溶液煮沸的作用是除去溶液中溶解的CO2,反应②滤液中加入氨水和过氧化氢冰水浴中反应生成过氧化钙晶体,过滤得到过氧化钙晶体,水洗、乙醇洗、烘烤得到过氧化钙固体,
(1)大理石中含铁的氧化物,大理石经过溶解、沉淀、过滤、再沉淀、再过滤,得到CaCO3,其目的是,除去杂质,得到纯净的碳酸钙(或提纯碳酸钙),过滤装置有烧杯、玻璃棒、漏斗,过滤需要用到的玻璃仪器主要有漏斗、烧杯和玻璃棒,
故答案为:除去杂质,得到纯净的碳酸钙(或提纯碳酸钙;玻璃棒;
(2)反应①的具体操作作为逐滴加入稀盐酸,至溶液中尚存有少量固体.将溶液煮沸,趁热过滤.将溶液煮沸的作用是,除去溶液中溶解的二氧化碳,
故答案为:除去溶液中溶解的CO2;
(3)反应②是滤液中加入氨水和过氧化氢冰水浴中反应生成过氧化钙晶体,反应的化学方程式为:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl或CaCl2+2NH3•H2O+H2O2=CaO2+2NH4Cl+2H2O,该反应需要在冰浴下进行,原因是过氧化氢热易分解,
故答案为:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl或CaCl2+2NH3•H2O+H2O2=CaO2+2NH4Cl+2H2O;温度过高时过氧化氢分解;
(4)白色晶体水洗时,表面可能粘有氯离子,结合氯离子的检验方法设计实验检验,白色晶体水洗时,判断是否洗净的方法是:取少量末次水洗液于试管中,滴加稀硝酸酸化后再滴加AgNO3 溶液,使用乙醉洗涤的目的是过氧化钙较稳定,不溶于乙醇,
故答案为:取少量末次水洗液于试管中,滴加稀硝酸酸化后再滴加AgNO3 溶液;去除晶体表面的水分;
(5)制备过氧化钙的另一种方法是:将石灰石锻烧后.直接加人双氧水反应,过滤后可得到过氧化钙产品混有杂质,该法的优点是工艺简单、操作简单.所得产品的缺点是得到产品纯度低,
故答案为:纯度较低;
(6)CaO2•8H2O加热脱水的过程中,需不断通入氧气.目的是抑制过氧化钙分解.若通入的氧气中混有二氧化碳,其后果是二氧化碳和过氧化钙发生反应生成碳酸钙,过氧化钙分解生成氧化钙和氧气,2CaO2=2CaO+O2↑,若所取产品质量为ag,测得生成气体的体积为VmL(已换算成标准状况),氧气物质的量=$\frac{V×1{0}^{-3}L}{22.4L/mol}$,则得到过氧化钙物质的量=$\frac{V×1{0}^{-3}}{22.4}×2$mol=$\frac{V×1{0}^{-3}}{11.2}$mol,
结合生成的氧气物质的量计算过氧化钙物质的量得到质量来计算过氧化钙的质量分数=$\frac{\frac{V×1{0}^{-3}}{11.2}×72g/mol}{ag}$×100%=.$\frac{9V}{1400a}$×100%,
故答案为:$\frac{9V}{1400a}$×100%.
点评 本题考查了制备和提纯的分析应用,实验基本操作、含量计算等知识点,掌握基础是解题关键,题目难度中等.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
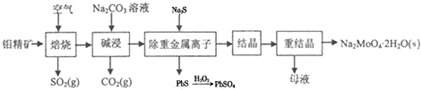
科目:高中化学 来源: 题型:实验题
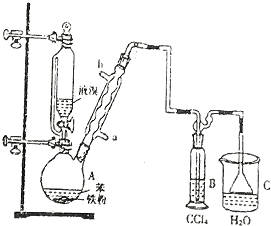
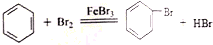 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
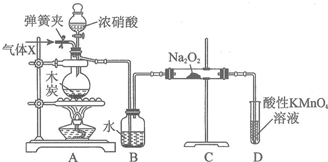
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应前后气体的压强之比为2:1 | |
| B. | 反应前后气体的密度之比为15:16 | |
| C. | 此时CO的转化率为50% | |
| D. | 如果反应继续向正向进行,气体的平均相对分子质量将减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:8 | B. | 5:4 | C. | 5:3 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
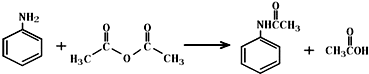
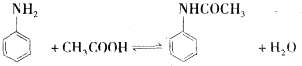
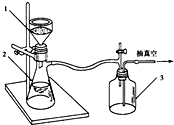 乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率.
乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率.| 名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 |
| 苯胺 | 93 | 无色油状液体,具有还原性 | 1.02 | 184.4 | 微溶于水,易溶于乙醇、乙醚等 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水,易溶于乙醇、乙醚 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com