

| ||
| ||
| 0.01mol |
| 0.1L |
| ||


科目:高中化学 来源: 题型:
 常温下用惰性电极电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(以下气体体积已换算成标准状况下的体积).根据图中信息回答下列问题.
常温下用惰性电极电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(以下气体体积已换算成标准状况下的体积).根据图中信息回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、P、S、Cl得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强 |
| B、ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C、若M+和R2-的核外电子层结构相同,则原子序数R>M |
| D、Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原电池的正极和电解池的阴极所发生的反应类型相同 |
| B、若在阳极附近的溶液中滴入KI淀粉试液,溶液呈蓝色 |
| C、若在阴极附近的溶液中滴入酚酞试液,溶液仍无色 |
| D、电解一段时间后,将全部电解液转移到烧杯中,加入适量盐酸充分搅拌后溶液可恢复原状况 |
查看答案和解析>>
科目:高中化学 来源: 题型:
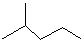 表示的分子式
表示的分子式 中含有的官能团的名称为
中含有的官能团的名称为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单位时间内消耗CO和CO2.的物质的量相等时,反应达到平衡状态 |
| B、平衡时,其他条件不变,升高温度可提高CO的转化率 |
| C、使用高效催化剂,提高正反应速率、降低逆反应速率 |
| D、平衡前,随着反应的进行,容器内压强始终不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com