

(1)水由液态凝结成冰时体积膨胀,其原因是“氢键”具有________性和_________性。
(2)1 mol冰中含有________mol“氢键”。
(3)在冰中,除“氢键”外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热是51 kJ·mol-1,则冰中“氢键”的键能是__________ kJ·mol-1。
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
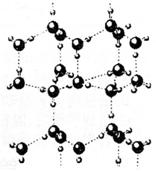
(1)1 mol冰中有___________ mol“氢键”。
(2)水分子可电离生成两种含有相同电子数的微粒,其电离方程式为_________________。
(3)用x、y、z分别表示H2O、H2S、H2Se的沸点(℃)则x、y、z的大小关系是__________。
(4)实验测得冰中氢键的作用能为18.8 kJ·mol-1,而冰的熔化热为5.0 kJ·mol-1,这说明______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com